Всі речовини в природі існують у вигляді газів, рідин або твердих тіл.
У разі досить відчутного стискання газ може бути зрідженим, якщо стискання відбувається за температури, що менша від критичної. У разі подальшого охолодження всі рідини твердіють, і тіла переходять із рідкого стану в твердий.
За своїми властивостями рідини схожі як на гази, так і на тверді тіла – кристали. Наприклад, подібно до газів, рідини набирають форму посудини, в якій вони містяться. З іншого боку, подібно до твердих тіл, рідини майже не стискаються, тобто мають певний власний об’єм. Вони мають досить велику густину і, як і тверді тіла, здатні опиратись не лише стисканню, а і розтягуванню.
Подвійний характер властивостей рідин зумовлений особливостями руху їх молекул. В газах вони рухаються хаотично і їх розташування невпорядковане. Навпаки, в кристалах частинки коливаються навколо певних положень рівноваги. Ці положення називають вузлами кристалічної решітки.
Молекули рідини, подібно до частинок твердого тіла, виконують коливання навколо деяких положень рівноваги. На відміну від твердих тіл ці положення рівноваги кожної молекули непостійні. Через деякий проміжок часу 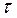 вони зміщуються на відстані порядку
вони зміщуються на відстані порядку 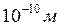 .
.
Певний час у фізиці та фізичній хімії панувала думка про те, що рідини за своїми властивостями подібні до реальних газів. Це пояснювалося успіхами теорії Ван-дер-Ваальса, що давала можливість пояснити деякі властивості рідини, виходячи з неперервності переходу між газоподібним та рідинним станами речовини.
Рідини можуть без розриву витримувати досить великі розтягуючі зусилля, якщо ці зусилля зводяться до всебічного від'ємного тиску, виключаючи можливість течії рідини (так звані розтягнуті рідини).
Наближення рідин за своїми властивостями до реальних газів в області високих температур та великих питомих об'ємів проявляється, наприклад, у тому, що за підвищення температури зменшується коефіцієнт поверхневого натягу рідин і питома теплота пароутворення, а також зменшується різниця між значеннями густин киплячої рідини та сухої насиченої пари.
Ретельний аналіз деяких властивостей рідин та твердих тіл свідчить, що відмінність між ними не дуже велика. Так, кристалічним тілам притаманна кристалічна плинність, що проявляється у вигляді пластичної деформації.
Рентгеноструктурний аналіз рідин засвідчив, що за температур, близьких до температури кристалізації, розташування частинок в рідинах не буде абсолютно неупорядкованим (як у газах). Є невеликі об’єми підвищеної густини з упорядкованим розташуванням частинок. Такі утворення називають сиботаксичними областями. Їх розміри 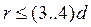 (
(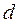 – ефективний діаметр молекули). Між цими областями розташування молекул неупорядковане, а густина рідини менша. У зв’язку з цим кажуть, що в рідинах існує ближній порядок.
– ефективний діаметр молекули). Між цими областями розташування молекул неупорядковане, а густина рідини менша. У зв’язку з цим кажуть, що в рідинах існує ближній порядок.
Порядок розташування частинок в кристалах зберігається у всьому об'ємі кристала, тому його називають дальнім. В рідинах, молекули яких мають витягнуту форму або форму плоских куль, спостерігається упорядковане розташування молекул. Їх називають рідкими кристалами.
Чимало фізичних властивостей рідин мало відрізняються від властивостей твердих тіл. Наприклад, під час плавлення твердих тіл відносне збільшення їх об'єму незначне (приблизно 10%). Отже, середні відстані між частинками речовини в процесі плавлення майже не змінюються, а під час випаровування вони збільшуються в десятки разів.
З огляду на зазначені вище особливості рідин, опрацювання теорії рідкого стану речовини зіткнулося на своєму шляху з великими труднощами, а тому ця теорія ще далека від завершення.
Френкель Я.І. та інші дослідники запропонували так звану діркову теорію рідини. Згідно з цією теорією при плавленні кристала між сиботаксичними групами виникають розриви – дірки. Внаслідок теплового руху дірки зникають в одних місцях, з’являються одночасно в інших, тобто відбувається хаотичний тепловий рух дірок. Ця модель узгоджується з результатами дослідів лише у разі малих тисків і не узгоджується у разі високих. Так, за малих тисків рідини стискаються в 10-15 разів більше, ніж тверді тіла. За високих тисків (що становлять тисячі атмосфер) стисливість рідин і твердих тіл відрізняється мало.
За температур, близьких до температур плавлення, тепловий рух в рідинах в основному зводиться до коливань молекул навколо деяких середніх положень рівноваги, які, на відміну від положень рівноваги в твердих тілах, мають тимчасовий характер. Молекула коливається навколо одного і того самого положення рівноваги на протязі деякого проміжку часу 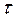 . Потім положення її рівноваги „перестрибує” на відстань, що (по порядку величини) дорівнює середній відстані
. Потім положення її рівноваги „перестрибує” на відстань, що (по порядку величини) дорівнює середній відстані 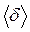 між сусідніми молекулами:
між сусідніми молекулами:
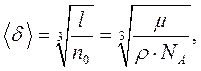
(9.1)
де 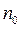 – число молекул в одиниці об'єму,
– число молекул в одиниці об'єму, 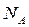 – число Авогадро,
– число Авогадро, 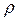 – густина рідини,
– густина рідини, 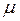 – її молярна маса. Наприклад, для води
– її молярна маса. Наприклад, для води 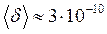 м.
м.
Середній час 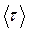 „осілого існування” молекули (середній час між двома послідовними „стрибками”) називають часом релаксації. Цей час таким чином залежить від температури
„осілого існування” молекули (середній час між двома послідовними „стрибками”) називають часом релаксації. Цей час таким чином залежить від температури 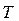 та енергії активації
та енергії активації 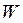 , необхідної для „стрибка”:
, необхідної для „стрибка”:
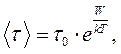 (9.2)
(9.2)
де 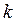 – стала Больцмана,
– стала Больцмана, 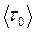 – середній період коливань молекули навколо положення рівноваги.
– середній період коливань молекули навколо положення рівноваги.
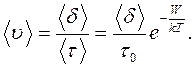 За час
За час 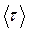 молекула переміщується в середньому на відстань
молекула переміщується в середньому на відстань 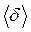 . Середня швидкість переміщення молекул:
. Середня швидкість переміщення молекул:
(9.3)
У рідинах, як і в газах, за наявності просторової неоднорідності концентрації, температури чи швидкості упорядкованого руху виникають явища переносу – дифузія, теплопровідність та внутрішнє тертя. Ці процеси тісно пов'язані з тепловим рухом молекул рідини і підпорядковуються таким самим законам Фіка, Фур’є та Ньютона, що й відповідні процеси в газах. Специфічні особливості теплового руху в рідинах позначаються лише на величинах коефіцієнтів переносу та їх залежності від параметрів стану.
Коефіцієнт дифузії в хімічно однорідній рідині можна обчислити за формулою, подібною до формули (7.9) для газів:
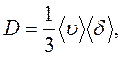 |
(9.4)
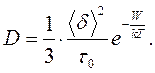 або враховуючи формулу (9.3):
або враховуючи формулу (9.3):
(9.5)
Коефіцієнт в'язкості (аналог коефіцієнта внутрішнього тертя в газах) залежить від температури рідини:
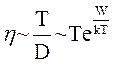 (9.6)
(9.6)
 2015-09-06
2015-09-06 860
860








