1. Обчислюють зниження температури замерзання розчину за рівнянням 3.8.
2. При визначенні істинної молярної маси електролітів кріометричним методом, необхідно використовувати органічні розчинники, в яких розчинена речовина не дисоціює. Обчислюють молярну масу розчиненої речовини за рівнянням 3.13.
3. Порівнюють одержані значення молярної маси з довідковими значеннями, що знаходяться у лаборанта.
4. Якщо розчинена речовина неелектроліт, визначають похибку вимірювань і на цьому роботу закінчують.
5. Якщо розчинена речовина електроліт, визначена молярна маса буде “уявною”, тобто значно меншою за дійсне значення за рахунок процесу дисоціації розчиненої речовини. Тому знаходять відношення 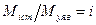 .
.
6. Знаючи і (ізотонічний коефіцієнт), можна визначити ступінь дисоціації за рівнянням 3.16.
Питання для самоперевірки
1. Сформулюйте закон Рауля. Для яких розчинів справджується цей закон?
2. Властивості якого компоненту розчину (розчиненої речовини чи розчинника) визначають кріоскопічну сталу?
3. Поясніть взаємозв’язок між зниженням тиску насиченої пари розчинника над розчином та зниженням температури замерзання розчину.
4. Поясніть зміст поняття “уявна” молярна маса розчиненої речовини.
5. Як практично визначити температуру замерзання розчину? Як визначити зниження температури замерзання розчину порівняно з розчинником?
6. Як визначити ступінь дисоціації слабкого електроліту за зниженням температури замерзання розчину?
7. Як обчислити молярну масу розчиненої речовини – неелектроліту за зниженням температури замерзання розчину?
8. Особливості термометра Бекмана. З якою точністю і в яких межах можна проводити виміри цим приладом?
9. Які величини можна розрахувати після експериментального визначення температури замерзання розчину?
 2015-09-06
2015-09-06 446
446








