В розчинах слабких електролітів при значних розведеннях іони рухаються незалежно один від одного і їх електрична провідність при нескінченному розведенні підпорядковується правилу адитивності, тому коли fl=1 рівняння (4.6) має вигляд
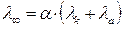 (4.7)
(4.7)
При нескінченному розведені величина ступеню дисоціації прямує до одиниці a=1, отже:
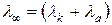 (4.8)
(4.8)
Виходячи із рівнянь 4.7 та 4.8, отримуємо закон Арреніуса:
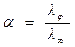 (4.9)
(4.9)
Математичний вираз рівняння (4.8) отримав назву закону Кольрауша: еквівалентна електрична провідність при нескінченному розведенні дорівнює сумі рухливостей іонів.
Електрична дисоціація являє собою зворотній процес, тому до нього може бути застосований закон діючих мас і константа електролітичної дисоціації, наприклад, для оцтової кислоти може бути записана
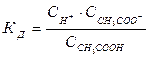
Якщо загальна концентрація С, а ступінь дисоціації a,
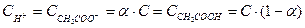 .
.
Тоді константа дисоціації з врахуванням (4.9) буде мати вигляд:
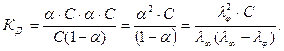 (4.10)
(4.10)
Рівняння (4.10) дістало назву закону розведення Оствальда, відповідно до якого константа електролітичної дисоціації за сталої температури не залежить від концентрації розчину (як константа рівноваги процесу дисоціації).
 2015-09-06
2015-09-06 659
659








