Опытным путем французским ученым Б. П. Э. Клапейроном в 1834 г. было установлено, что при комнатной температуре и атмосферном давлении параметры состояния газов (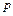 ,
, 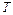 ,
, 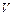 ) довольно хорошо подчиняются уравнению:
) довольно хорошо подчиняются уравнению:
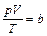 , (3.1)
, (3.1)
где 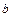 – константа, пропорциональная массе газа. Причем, чем меньше плотность газа, тем точнее выполняется это уравнение.
– константа, пропорциональная массе газа. Причем, чем меньше плотность газа, тем точнее выполняется это уравнение.
У разреженных газов молекулы практически не взаимодействуют между собой. Газ, молекулы которого считают материальными точками и пренебрегают взаимодействием между ними силами притяжения и отталкивания, называют идеальным газом. Такой газ строго подчиняется уравнению (3.1), которое называется уравнением состояния идеального газа.
Согласно закону Авогадро при нормальных условиях (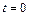 0С,
0С, 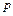 =1 атм.) моль любого газа занимает один и тот же объем – 22,4 литра. Один моль газа – это такое количество газа, в котором содержится столько же структурных единиц (атомов, молекул), сколько атомов содержится в изотопе углерода
=1 атм.) моль любого газа занимает один и тот же объем – 22,4 литра. Один моль газа – это такое количество газа, в котором содержится столько же структурных единиц (атомов, молекул), сколько атомов содержится в изотопе углерода 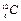 массой 0,012 кг. Следовательно, когда количество газа равно 1 моль, константа
массой 0,012 кг. Следовательно, когда количество газа равно 1 моль, константа 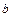 в уравнении (3.1) будет одинаковой для всех газов. Эту константу обозначают через
в уравнении (3.1) будет одинаковой для всех газов. Эту константу обозначают через 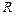 и называют универсальной газовой постоянной. Запишем уравнение состояния идеального газа следующим образом:
и называют универсальной газовой постоянной. Запишем уравнение состояния идеального газа следующим образом:
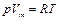 , (3.2)
, (3.2)
где 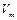 – объем 1 моля газа.
– объем 1 моля газа.
Из закона Авогадро можно определить значение универсальной газовой постоянной:
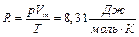 . (3.3)
. (3.3)
Для произвольной массы газа уравнение состояния записывается в виде:
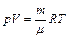 , (3.4)
, (3.4)
где 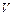 – объем газа массой
– объем газа массой 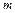 ,
, 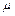 – молярная масса газа (масса 1 моля газа),
– молярная масса газа (масса 1 моля газа), 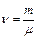 – число молей газа. Это уравнение называется уравнением Менделеева–Клапейрона.
– число молей газа. Это уравнение называется уравнением Менделеева–Клапейрона.
Уравнение состояния идеального газа можно также представить в виде:
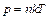 , (3.5)
, (3.5)
где 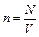 – концентрация молекул газа,
– концентрация молекул газа, 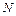 – число молекул газа, находящихся в объеме
– число молекул газа, находящихся в объеме 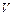 ,
, 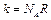 – постоянная Больцмана,
– постоянная Больцмана, 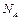 – число молекул в 1 моле газа (число Авогадро).
– число молекул в 1 моле газа (число Авогадро).
Отношение массы газа к занимаемому им объему определяет его плотность: 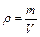 . Из формулы (3.4) плотность идеального газа можно выразить так:
. Из формулы (3.4) плотность идеального газа можно выразить так:
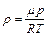 . (3.6)
. (3.6)
2. Описание экспериментальной установки
 Установка ФПТ1–12 (рис. 3.1) состоит из измерительного блока 1 и колбы 3, установленной на весах 2. В измерительном блоке установлен вакуумметр 4. На лицевой панели блока расположены органы управления и световой индикации, термометр 5 для определения температуры окружающей среды; внутри блока установлен компрессор.
Установка ФПТ1–12 (рис. 3.1) состоит из измерительного блока 1 и колбы 3, установленной на весах 2. В измерительном блоке установлен вакуумметр 4. На лицевой панели блока расположены органы управления и световой индикации, термометр 5 для определения температуры окружающей среды; внутри блока установлен компрессор.
Колба установлена на весах и соединена с вакуумметром вакуумной трубкой. Соединение компрессора со штуцером измерительного блока осуществляется также с помощью вакуумной трубки.
3. Выполнение упражнений и обработка результатов измерений
1. Включить установку тумблером «Сеть». При этом загорается сигнальная лампа.
2. Нарисовать таблицу 3.1.
3. Измерить температуру воздуха в лаборатории и записать ее значение в таблицу.
4. С помощью электронных весов определить массу колбы с воздухом 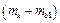 при давлении воздуха в колбе
при давлении воздуха в колбе 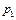 (
(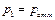 – атмосферное давление). Результат занести в таблицу.
– атмосферное давление). Результат занести в таблицу.
5. Включить компрессор кнопкой «Пуск» и, удерживая ее нажатой, откачать воздух из колбы до давления 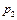 . После чего, закрыв кран и выключив компрессор (отпустив кнопку «Пуск»), определить массу колбы с воздухом
. После чего, закрыв кран и выключив компрессор (отпустив кнопку «Пуск»), определить массу колбы с воздухом 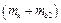 при давлении
при давлении 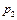 . Данные занести в таблицу.
. Данные занести в таблицу.
6. Повторить измерения по п. 5 еще не менее 4 раз.
7. Выключить установку тумблером «Сеть».
Таблица 3.1
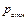 = Па, = Па, 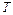 = К, = К, 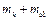 = кг = кг
| |||||
| № | 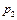 , Па , Па
| 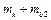 ,
кг ,
кг
| 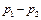 , Па , Па
| 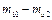 ,
кг ,
кг
| 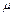 , , 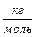
|
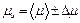 , , 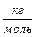 ; ;  = = 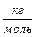
|
8. Для каждого проведенного измерения определить значения 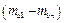 и разность давлений
и разность давлений 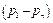 .
.
9. Рассчитать значение молярной массы воздуха для давлений 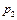 , полученных в каждом опыте, по формуле:
, полученных в каждом опыте, по формуле:
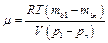 . (3.7)
. (3.7)
10. Определить среднее значение молярной массы 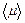 и рассчитать погрешность ее измерения.
и рассчитать погрешность ее измерения.
11. Записать окончательный результат и сравнить его с табличным.
12. С помощью формулы (3.6) рассчитать плотность воздуха и определить погрешность измерения. Сравнить полученное значение с табличным.
Контрольные вопросы
1. Какой газ называется идеальным?
2. Дайте формулировку закона Авогадро. Что такое моль вещества?
3. Какие параметры называют параметрами состояния газа? Их физический смысл.
4. Как определяется значение универсальной газовой постоянной?
5. Как получена формула (3.4)?
6. Что такое плотность газа? Как она определяется для идеального газа?
7. Как определяется постоянная Больцмана?
8. Каким образом можно найти значение молярной массы смеси газов?
9. Объясните методику расчета плотности газа в данной работе.
10. Выведите рабочую формулу (3.7).
 2015-09-06
2015-09-06 309
309







