Фазами системы называют ее однородные части, которые находятся в физически различных состояниях и отделены друг от друга границами раздела. Например, в закрытом сосуде заключена некоторая масса воды, в которой плавают кусочки льда и над которой находится смесь воздуха с водяными парами. Эта система является трехфазной. Она состоит из твердой фазы (лед), жидкой (вода) и газообразной (смесь воздуха с водяными парами).
Фазовым превращением, или фазовым переходом, называется переход вещества из одной фазы в другую. Различают два типа фазовых переходов.
Фазовые переходы первого рода – фазовые превращения, при которых скачкообразно изменяются такие характеристики вещества, как плотность, удельный и молярный объем, концентрации компонентов и, что особенно характерно, выделяется или поглощается теплота, называемая скрытой теплотой перехода. Примерами таких переходов являются превращения вещества из одного агрегатного состояния в другое.
Фазовые переходы второго рода – фазовые превращения, при которых нет скрытой теплоты перехода, а скачкообразно изменяются теплоёмкость, удельная электрическая проводимость, вязкость и некоторые другие характеристики вещества. Примерами таких переходов являются переход металлов в сверхпроводящее состояние, переход вещества из ферромагнитного в парамагнитное состояние.
Фазовые переходы первого рода, в отличие от фазовых переходов второго рода, относятся к числу явлений, достаточно хорошо исследованных к настоящему времени и хорошо описываемых законами молекулярной физики.
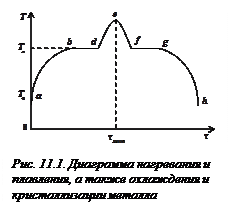 Рассмотрим основные особенности фазовых переходов первого рода, проанализировав диаграмму нагревания и плавления, а также охлаждения и кристаллизации металла. Качественный вид диаграммы показан на рис. 11.1. Здесь на оси абсцисс отложено время
Рассмотрим основные особенности фазовых переходов первого рода, проанализировав диаграмму нагревания и плавления, а также охлаждения и кристаллизации металла. Качественный вид диаграммы показан на рис. 11.1. Здесь на оси абсцисс отложено время 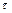 , а на оси ординат – температура
, а на оси ординат – температура 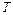 образца,
образца, 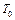 – начальная (комнатная) температура. Температура металла повышается сначала быстро, потом медленно (участок
– начальная (комнатная) температура. Температура металла повышается сначала быстро, потом медленно (участок 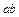 ). Чем выше температура, тем больше потери теплоты в окружающее пространство, поэтому происходит замедление нагрева. При некоторой температуре
). Чем выше температура, тем больше потери теплоты в окружающее пространство, поэтому происходит замедление нагрева. При некоторой температуре 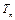 начинается процесс плавления, и, пока он идет, температура не меняется. На графике получается горизонтальная линия – участок
начинается процесс плавления, и, пока он идет, температура не меняется. На графике получается горизонтальная линия – участок 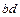 . В это время происходит изотермическое плавление, и вся сообщенная телу теплота идет на разрушение его кристаллической решетки. Когда заканчивается процесс плавления, образуется жидкая фаза, и ее температура начинает повышаться (участок
. В это время происходит изотермическое плавление, и вся сообщенная телу теплота идет на разрушение его кристаллической решетки. Когда заканчивается процесс плавления, образуется жидкая фаза, и ее температура начинает повышаться (участок 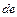 ). Если в некоторый момент времени
). Если в некоторый момент времени 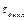 прекратить нагрев жидкости и начать ее охлаждать, то кривая пойдет вниз (участок
прекратить нагрев жидкости и начать ее охлаждать, то кривая пойдет вниз (участок 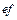 ). Когда температура понизится до
). Когда температура понизится до 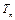 , то начнется процесс кристаллизации. Этот процесс протекает с выделением скрытой теплоты перехода. Пока атомы и молекулы жидкой фазы переходят в твёрдую, образуют кристаллическую решетку, температура металла остается неизменной. На графике возникает второй горизонтальный участок
, то начнется процесс кристаллизации. Этот процесс протекает с выделением скрытой теплоты перехода. Пока атомы и молекулы жидкой фазы переходят в твёрдую, образуют кристаллическую решетку, температура металла остается неизменной. На графике возникает второй горизонтальный участок 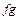 . Когда процесс кристаллизации закончится, прекратится и выделение скрытой теплоты перехода и образец начнет охлаждаться (участок
. Когда процесс кристаллизации закончится, прекратится и выделение скрытой теплоты перехода и образец начнет охлаждаться (участок 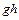 ).
).
Энтропией называется функция состояния термодинамической системы, дифференциал которой 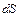 при обратимом процессе равен отношению бесконечно малого количества теплоты
при обратимом процессе равен отношению бесконечно малого количества теплоты 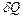 , сообщенного системе, к термодинамической температуре
, сообщенного системе, к термодинамической температуре 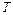 системы:
системы:
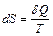 . (11.1)
. (11.1)
Энтропия всегда определяется с точностью до постоянной величины, поэтому смысл имеет лишь ее изменение при переходе системы из состояния 1 в состояние 2: 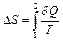 .
.
Найдем изменение энтропии металла при его переходе из состояния 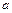 в состояние
в состояние 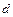 (рис. 11.1). Оно определяется как сумма изменений энтропии при нагревании (участок
(рис. 11.1). Оно определяется как сумма изменений энтропии при нагревании (участок 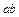 ) и плавлении (участок
) и плавлении (участок 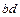 ):
):
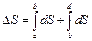 . (11.2)
. (11.2)
После подстановки выражения (11.1) в формулу (11.2) получим:
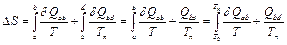 , (11.3)
, (11.3)
где 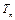 – температура плавления. Учитывая, что
– температура плавления. Учитывая, что 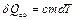 , где
, где 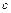 – удельная теплоёмкость,
– удельная теплоёмкость, 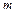 – масса образца и
– масса образца и 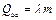 , где
, где  – удельная теплота плавления, из соотношения (11.3) получим:
– удельная теплота плавления, из соотношения (11.3) получим:
 . (11.4)
. (11.4)
Отметим, что оба слагаемых в формуле (11.4) положительны.
 2015-09-06
2015-09-06 233
233








