Для визначення дуже малих концентрацій (~10–6 ÷ 10–7 моль/л) деяких речовин використовують каталітичну здатність цих речовин впливати на протікання кольорової реакції в реакційній системі, причому швидкість утворення забарвленого продукту реакції пропорційна концентрації каталізатора.
Метою даної роботи є визначення концентрації вольфраму (VI) у водному розчині на основі його каталітичного впливу на реакцію окиснення йодид-іонів пероксидом водню в кислому середовищі до вільного йоду:
Н2О2 + 2 І– + 2 Н+ → І2 + 2 Н2О
У відсутності каталізаторів (сполук вольфраму, молібдену, цирконію, танталу, феруму та деяких інших) реакція протікає повільно, а в їх присутності — швидко.
Залежність швидкості реакції від концентрації реаґуючих речовин виражається рівнянням:
dx/dτ = K× 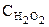 ×Cw×(
×Cw×(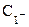 – Х)
– Х)
де dx/dτ — швидкість реакції; К — умовна константа швидкості реакції, у величину якої входять значення концентрації речовин, взятих у надлишку; Х — концентрація виділеного йоду; 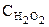 — концентрація Н2О2 (береться у надлишку); Сw — концентрація натрій вольфрамату;
— концентрація Н2О2 (береться у надлишку); Сw — концентрація натрій вольфрамату; 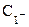 — початкова концентрація йодиду.
— початкова концентрація йодиду.
Про швидкість реакції можна судити за зміною забарвлення розчину, яка зв’язана з виділенням йоду. Додавання в розчин крохмалю дає можливість виявити досить малі концентрації йоду (Х), і тому для вимірювання швидкості реакції можна обмежитись початковим її періодом, коли Х << 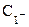 . У зв’язку з цим, для початку реакції можна прийняти, що
. У зв’язку з цим, для початку реакції можна прийняти, що 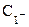 – Х ≈
– Х ≈ 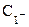 і тоді
і тоді
dx/dτ = K× 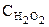 ×Cw×
×Cw× 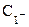
Між концентрацією йоду (Х), що утворюється внаслідок реакції, і часом взаємодії τ існує пропорційна залежність:
Х = К× 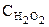 ×Cw×τ
×Cw×τ
На основі цього можна побудувати графік залежності Х = f (τ) і визначити швидкість реакції за значенням тангенса кута нахилу α відповідної прямої (рис. 5а). Замість Х на практиці при побудові графіка відкладають пропорційну йому величину — оптичну густину А, яка зв’язана з концентрацією забарвленої речовини.
Оскільки концентрація забарвленої речовини (Х) при постійних значеннях концентрацій реаґуючих речовин (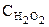 та
та 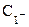 ) пропорційна концентрації визначуваної речовини-каталізатора Cw, можна побудувати графік залежності між тангенсами кутів нахилу прямих А= f (τ) першого графіка і концентраціями стандартних розчинів речовини-каталізатора (Cw) (рис. 5б).Цей (другий) графік і буде калібрувальним і за його допомогою можна знайти концентрацію речовини-каталізатора (в даному випадку — натрій вольфрамату (VI)).
) пропорційна концентрації визначуваної речовини-каталізатора Cw, можна побудувати графік залежності між тангенсами кутів нахилу прямих А= f (τ) першого графіка і концентраціями стандартних розчинів речовини-каталізатора (Cw) (рис. 5б).Цей (другий) графік і буде калібрувальним і за його допомогою можна знайти концентрацію речовини-каталізатора (в даному випадку — натрій вольфрамату (VI)).
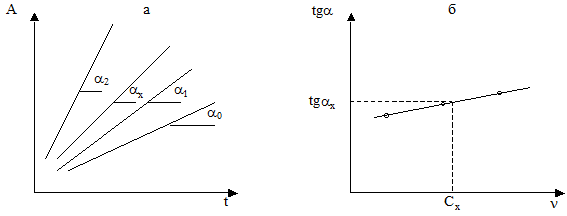
Рис. 5. Графіки залежності: а ― оптичної густини від часу; б ― тангенса кута
нахилу відповідної прямої від концентрації каталізатора.
 2015-09-06
2015-09-06 534
534








