Химическая связь, для которой линия, соединяющая атомные ядра, является осью симметрии связывающею электронною облака, называется s-связью. s -связь возникает при "лобовом" перекрывании атомных орбиталей. В молекуле этилена каждый атом углерода образует по три s-связи: одну — друг с другом, а две другие — с двумя атомами водорода. Имеющиеся у атомов углерода негибридные орбитали образуют одну так называемую p-связь. Химическая связь, для которой связывающее электронное облако имеет только плоскость симметрии, проходящую через атомные ядра, называется p-связью. На рис. 1.10. p-связь показана пунктиром. В действительности при образовании p-связей происходит "боковое" перекрывание атомных орбиталей (рис).
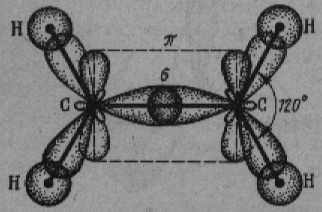
Рис. 1.10. Строение молекулы этилена
энергия двойной связи меньше удвоенной энергии одинарной связи, которая всегда является s -связью.
Приведенные примеры дают основание утверждать, что одинарная связь всегда является чистой или гибридной s -связью. Двойная связь состоит из одной s- и одной p-связи.
Наконец, тройная связь слагается из одной s- и двух p-связей, расположенных перпендикулярно друг другу. Примером может являться молекула ацетилена (С2Н2) или азота, центральный атом подвергается sp – гибридизации, валентный угол в этой молекуле 180°, строение – линейное.
 2015-09-06
2015-09-06 3268
3268








