Электрический момент диполя является мерой полярности молекулы. Между взаимодействующими атомами, которые различаются по электроотрицательности, возникают полярные связи. В результате смещения электронной плотности в сторону более электроотрицательного партнера происходит разделение «центров тяжести» положительного и отрицательного зарядов и возникает диполь, представляющий собой систему из двух равных и противоположных по знаку зарядов d+ и d‾, находящихся на определенном расстоянии l (длина диполя) друг от друга. Диполь выражают через электрический момент диполя m, который представляет собой произведение заряда d на длину диполя l: m = d× l.
Например, строение линейной молекулы СО2, можно представить следующим образом:

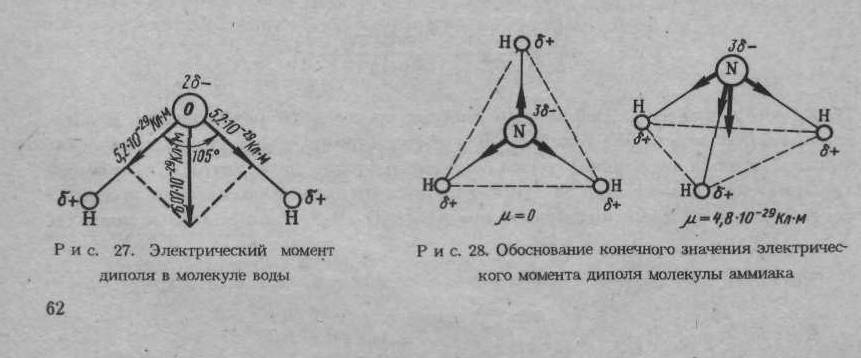
Направление электрического момента диполя условно принимают от отрицательного к положительному полюсу диполя. Классическим примером диполя могут служить угловая молекула воды, в которой электрические моменты диполя каждой связи О – Н равны 5,2 × 10-29 Кл × м, а электрический момент диполя молекулы воды в целом составляет 6,07 × 10-29 Кл × м. Следовательно, электрические моменты диполя связей складываются геометрически и связи О – Н должны быть направлены под углом 105 ° друг к другу (рис. 1.3.). Таким образом, существование электрических моментов диполей в молекулах и их величина определяются пространственной направленностью химической связи.
 2015-09-06
2015-09-06 1895
1895
