А)
| Энтропия (S)– физическая величина, характеризующая степень неупорядоченности систем, состоящих из большого числа частиц, находящихся в тепловом движении. |
Таким образом,
| чем БОЛЬШЕ ПОРЯДКА – тем МЕНЬШЕ ЭНТРОПИЯ, чем МЕНЬШЕ ПОРЯДКА – тем БОЛЬШЕ ЭНТРОПИЯ. |
Единица измерений энтропии [ S ] = 1 Дж/К, энтропия, относящаяся к 1 моль вещества измеряется в Дж/(моль∙К). Энтропия возрастает при нагревании вещества и уменьшается при его охлаждении. Особенно сильно она возрастает при переходе вещества из твердого в жидкое и из жидкого в газообразное состояние. При смешении двух разных газов степень неупорядоченности возросла. Следовательно, возросла энтропия системы. При нулевом тепловом эффекте это и послужило причиной самопроизвольного протекания процесса. Если теперь мы захотим разделить смешавшиеся газы, то нам придется совершить работу, то есть затратить для этого энергию. Самопроизвольно (за счет теплового движения) смешавшиеся газы никогда не разделятся!
Критерием направленности процесса в изолированной системе может служить степень ее неупорядоченности, энтропия. В изолированной системе самопроизвольные процессы протекают в сторону увеличения энтропии. Таким образом, если в результате процесса D r S > 0, то процесс термодинамически возможен, если же D r S < 0, то его самопроизвольное протекание в изолированной системе исключается.
Изменение энтропии процесса D S равно разности между суммами энтропий продуктов реакции и исходных веществ:
ΔrS= Σ ν Sпродуктов реакции - Σ ν Sисходных веществ .(2.4)
В неизолированных системах возможны процессы, сопровождающиеся уменьшением энтропии.
Функция состояния D r G, учитывающая совместное влияние энтальпийного и энтропийного факторов, представляет собой разность
ΔrG0 = ΔrН 0– ТΔrS0. (2.5)
и называется свободной энергией Гиббса. Она является мерой устойчивости системы при постоянном давлении.
Судить о возможности самопроизвольного протекания процесса можно по знаку изменения функции свободной энергии: если D r G < 0, то процесс термодинамически возможен; если D r G>0, то протекание процесса в данных условиях термодинамически невозможно. Таким образом, все процессы могут самопроизвольно протекать в сторону уменьшения свободной энергии. Это утверждение справедливо как для изолированных, так и для неизолированных систем.
Изобарно-изотермический потенциал реакции рассчитывается так же, как и тепловой эффект реакции – по стандартным теплотам образования веществ:
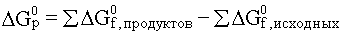
В изохорно-изотермических условиях свободная энергия называется энергией Гельмгольца или изохорно-изотермическим потенциалом и равна

Она характеризует направление и предел самопроизвольного течения химической реакции при изохорно-изотермических условиях, которое возможно при ΔF < 0.
 2015-09-06
2015-09-06 2477
2477
