Ферменты или энзимы представляют собой высокоспециализированный класс веществ белковой природы, используемых живыми организмами для осуществления многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение большого разнообразия химических соединений
Жизнь и многообразие ее проявлений – это сложная совокупность химических реакций, катализируемых ферментами. Ферменты отличаются рядом характерных свойств от неорганических катализаторов: ферменты чрезвычайно эффективны и проявляют каталитическую активность в условиях температуры тела, нормального давления и (в основном) при нейтральных значениях рН. Каждый фермент катализирует, как правило, только одну химическую реакцию, т.е. ферменты высоко специфичны. Каждый фермент имеет специфическую первичную структуру, активность фермента контролируется как на генетическом уровне, так и посредством низкомолекулярных соединений: субстратов и продуктов реакций, катализируемых этими же ферментами.
Молекула фермента имеет уникальную структуру и, соответственно, уникальную функцию.
Учение о ферментах – ферментология, энзимология (греч. enzyme – в дрожжах, лат. fermentatio – брожение) исторически связано с процессом брожения, выделением газов.
Энзимология решает вопросы: а) молекулярной структуры ферментов; б) природы химических взаимодействий, лежащих в основе ферментативного катализа. Изучение ферментов имеет огромное значение как в теоретическом, так и в прикладном плане. Ферменты применяются в различных отраслях промышленности, сельского хозяйства, медицины. Например, вопросы заготовки кормов – сушка травы, приготовление сенажа, силоса, применение ферментных препаратов в качестве добавок к кормам – все рассчитаны на процессы, связанные с активностью ферментов.
Фармакологическое действие многих лекарственных препаратов основано на определенном механизме взаимодействия их с ферментами.
Процессы пищеварения, всасывания, все проявления жизни – рост, развитие – все связаны с действием определенных ферментов.
История. Явления брожения и переваривания известны давно, но учение о ферментах зародилось в 1814 г., когда Петербургский ученый Кирхгоф показал, что не только проросшее зерно ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. В последующем были открыты другие ферменты, в частности пепсин, трипсин, вызывающие гидролиз белков в желудочно-кишечном тракте. Наибольшее внимание исследователей привлекали процессы окисления в организме. Например, было известно, что горение сахара на воздухе происходит медленно, если же добавить немного солей лития, то горение сахара идет очень интенсивно в соответствии со следующим уравнением:
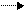 C6H12O6+ 6O2 6CO2+ 6H2O
C6H12O6+ 6O2 6CO2+ 6H2O
В живых организмах "горение", точнее окисление углеводов также протекает быстро и до тех же конечных продуктов, т.е. CO2 и H2O с выделением энергии. Однако, эта реакция происходит при относительно низкой температуре, без пламени, в присутствии воды. Это "горение", окисление сахара в организме происходит под действием биологических катализаторов – ферментов. Сейчас известно, что при окислении глюкозы до CO2 и H2O участвуют до 15 различных ферментов.
Биологические катализаторы – ферменты осуществляют те же реакции, которые возможны по термодинамическим условиям, но они их лишь ускоряют, так же, как и неорганические катализаторы. Пример: перекись водорода H2O2 может медленно расщепляться на молекулярный кислород O2 и H2O и в отсутствие катализатора, но в присутствии платины (порошок) эта реакция идет с высокой скоростью:
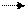 2H2O2 2H2O + O2
2H2O2 2H2O + O2
платина или каталаза
Эту же реакцию можно провести с высокой скоростью в присутствии фермента каталазы (например, содержащегося в эритроцитах), при этом образуются те же конечные продукты.
Таким образом, можно считать установленным, что ферменты катализируют ряд химических реакций, аналогичных химическим реакциям, катализирующимся неорганическими веществами.
Ферменты долгое время считали "организованными" (Л.Пастер) и "неорганизованными", т.к. полагали, что ферменты, сбраживающие сахар, связаны с целой клеткой, а кипячение инактивирует фермент. Лишь опыты М.М. Манасеина (1871 г., растертые с измельченным песком дрожжи), Бухнера (1897 г. дрожжевой сок, полученный под давлением 500 атм.), Лебедева A.H. (зимаза из дрожжей, получена настаиванием высушенных дрожжей в теплой воде) показали, что ферментативная активность не связана с целой клеткой, что фермент может быть выделен из клеток. Это послужило началом детального изучения процесса анаэробного окислительно-восстановительного расщепления углеводов. В настоящее время установлено, что любая химическая реакция, протекающая в организме может быть осуществлена вне организма, если удается выделить соответствующий фермент, катализирующий данную реакцию. Правда следует учесть, что ряд ферментов прочно связан с морфологическими структурами клетки – с биомембранами. В целостном организме имеется тесная связь между функцией фермента и его структурой, связанной с клеточными образованиями.
 2015-10-16
2015-10-16 1075
1075
