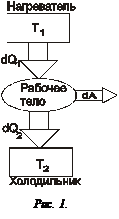
В механике равновесное состояние системы определялось минимумом энергии, однако в термодинамике этого условия уже недостаточно, например:
|
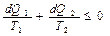 . (4)
. (4)
Величина 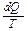 , т.е. отношение теплоты, полученной телом, к температуре процесса называется приведенной теплотой. Соотношение (4) показывает, что сумма приведенных теплот в цикле меньше или равна нулю. Так же как и раньше, знак "<" относится к необратимым циклам, а знак "=" к обратимым. Клаузиус показал, что этот результат справедлив для любого цикла и записывается:
, т.е. отношение теплоты, полученной телом, к температуре процесса называется приведенной теплотой. Соотношение (4) показывает, что сумма приведенных теплот в цикле меньше или равна нулю. Так же как и раньше, знак "<" относится к необратимым циклам, а знак "=" к обратимым. Клаузиус показал, что этот результат справедлив для любого цикла и записывается:
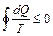 . (5)
. (5)
Выражение (5) называется неравенством Клаузиуса. Для простоты рассмотрим обратимый процесс. Из теории криволинейных интегралов известно, что если криволинейный интеграл равен нулю, то под интегралом стоит полный дифференциал некоторой функции S. Т.е. dQ/T=dS. Функция S была названа энтропией. В общем случае 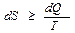 , где знак ">" относится к необратимым процессам, а знак "=" – к обратимым.
, где знак ">" относится к необратимым процессам, а знак "=" – к обратимым.
 2015-10-16
2015-10-16 314
314







