Обратите внимание: если все характеристики элементов, простых веществ и соединений имеют закономерности по группе одни изменения, а по периоду – другие, то у ЛВС эти изменения аналогичны.
4). Электроотрицательность – свойство атомов химических элементов притягивать к себе электроны от других атомов. Атом более электроотрицательного элемента, смещая на себя общие (общую) электронную пару, приобретает отрицательную степень окисления, а менее электроотрицательный – положительную. Например: Si+4C–4

электроотрицательность увеличивается (до VII группы) Самый электроотрицательный элемент – фтор (F)
F O N Cl Br S C I P H (металлы) – наизусть
электроотрицательность уменьшается (самый электроположительный – франций (Fr)
 |
5). атомный радиус уменьшается
атомный радиус увеличивается
6). Энергия ионизация – энергия, необходимая для отрыва одного электрона, наименее прочно связанного с ядром.
 |
энергия ионизации увеличивается
энергия ионизации уменьшается.
Д. И. Менделеев не смог объяснить причину, по которой свойства элементов периодически повторяются.
Объяснение причины периодичности. Позже стало известно, что атом имеет сложное строение: в центре атома расположено ядро, в котором сосредоточена вся масса атома. В состав атомного ядра входят протоны и нейтроны. Количество протонов в ядре атома совпадает с его порядковым номером в таблице Д.И.Менделеева. Количество электронов в атоме равно числу протонов, поэтому атом электронейтрален.
Если рассмотреть строение внешних уровней атомов, то окажется, что количество электронов периодически повторяется, изменяясь от 1 до 8. В этом и заключается причина периодических изменений свойств элементов.
Современная формулировка закона. Теперь периодический закон формулируют так: свойства простых веществ, а также формы, и свойства их соединений находятся в периодической зависимости от зарядов ядер атомов.
В таблице каждый химический элемент имеет атомный номер, который определяется числом протонов в ядре атома, т. е. атомный номер численно равен заряду ядра. Таким образом, основной признак, который определяет химический элемент, — это заряд его ядра. Массу атома в основном определяют протоны и нейтроны, составляющие ядро.
Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера (повторение того, что обозначено выше в виде схем).
Периодичность свойств атомов и сложных веществ:
а) Металлические и неметаллические свойства
б) кажущийся радиус атома
в) энергия ионизации (энергия, необходимая для отрыва электрона, наименее прочно связанного с ядром)
г) относительная электроотрицательность
д) минимальная и максимальная степень окисления
е) свойства высших оксидов, гидроксидов, летучих водородных соединений.
Что надо уметь:
1). Определять число электронов, протонов, нейтронов в атомах, молекулах и ионах (катионах и анионах).
2). Составлять электронные и графические формулы атомов (в основном и возбужденном состоянии), ионов (катионов и анионов).
3). Определять минимальную, максимальную и промежуточные степени окисления атома по положению элемента в ПСХЭ.
4). Составлять формулы высших оксидов и гидроксидов (для элемента в высшей степени окисления). Знать, как изменяется характер этих соединений в зависимости от зарядов ядер атомов.
5). Составлять формулы летучих водородных соединений, знать их характер и как он изменяется в зависимости от зарядов ядер атомов.
6). Составлять формулы бинарных соединений по минимальной и максимальной степени окисления.
7). Сравнивать элементы по электроотрицательности, металлическим и неметаллическим свойствам, окислительным и восстановительным свойствам, радиусам атомов.
8). Считать степень окисления в молекулах и ионах.
Строение атома:
а) ядро, электронная оболочка. Частицы ядра: протоны и нейтроны
б) изотопы
в) связь между положением элемента в таблице Менделеева и строением его атома:
физический смысл порядкового номера, номера группы, номера периода.
Строение атома.
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность движущихся вокруг ядра электронов.
Атомное ядро – центральная часть атома, состоящая из нуклонов – протонов и нейтронов, связанных между собой ядерными силами.
Протон р+ Нейтрон n0 Электрон е
Заряд частицы +1 0 -1
Масса частицы 1 а.е.м. 1 а.е.м. 1/1840 от массы протона
Заряд ядра атома соответствует атомному номеру элемента в периодической системе (Z).
Так как атом - электронейтральная частица, то число протонов должно быть равно числу электронов (число + = числу -):
N(e-) = N(p) = Z
Массовое число А – складывается из числа протонов и нейтронов в ядре данного атома. Тогда число нейтронов легко найти, вычитая заряд ядра атома из массового числа.
А = N(p) + N(n) N(n) = A – Z
Пример: определить число протонов и нейтронов в ядре атома мышьяка с массовым числом 75.
 массовое число
массовое число
75
заряд ядра атома 33 As
Решение: порядковый номер у As – 33. Следовательно, заряд ядра Z= +33, число протонов – 33. Число нейтронов: A – Z = 75 – 33 = 42.
Химический элемент – вид атомов, с определённым зарядом ядра.
Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов (существуют элементы, которые в природе представлены только одним изотопом, например, фосфор и фтор).
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т.е разным числом нейтронов в ядре.
Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Пример: изотопы углерода: 12С и 13С. Значит, они отличаются по составу на 1 нейтрон: у 12С – 6 нейтронов, у 14С – 7 нейтронов.
Водород имеет три изотопа: протий 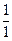 Н, дейтерий
Н, дейтерий 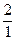 Н и тритий
Н и тритий 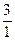 Н
Н
Электронное строение атома.
1). Электронная оболочка атома состоит из электронных слоев или уровней.
Номер периода, в котором находится атом данного химического элемента, показывает число энергетических слоев (уровней) в его атоме. Электронные уровни обозначаются целыми числами 1, 2,.., n, начиная от ближайшей к ядру.
2). Номер группы, в которой находится атом данного химического элемента, соответствует числу электронов на внешнем слое атома (это справедливо только для элементов главных подгрупп).
На внешнем слое атомов элементов побочных подгрупп находится почти всегда 2 электрона (по 1 электрону на внешнем слое у атомов хрома, молибдена, меди, серебра и золота).
3). Максимальное количество электронов на уровне можно определить по формуле:
N=2n2 , где n – номер уровня, для которого мы делаем расчет, а N – максимально возможное число электронов на слое. В соответствии с этой формулой на 1 слое не может быть больше 2-х электронов, на 2-ом – более 8, на 3-ем – более 18 и т.д.
4). Если уровень содержит максимально возможное число электронов, его называют завершенным. Если меньше максимального, то незавершенным.
5). На внешнем слое атомов не может содержаться более 8-ми электронов (у атомов 1 периода – более 2-х).
6). Уровни, в свою очередь, могут состоять из близких по энергии подуровней. Их обозначают символами s, p, d, f.
Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей. На каждой орбитали может быть не больше двух электронов.
На схеме орбитали обозначают в виде ячеек: ¨, а электроны - в виде стрелок: или ¯.
Электроны при движении создают облако определенной формы.
Электронные конфигурации атомов
Распределение электронов по подуровням называется электронной конфигурацией, а по орбиталям – графической.
На каждом s-подуровне (одна орбиталь) могут находиться два электрона, на каждом p-подуровне (три орбитали) - шесть электронов, на каждом d-подуровне (пять орбиталей) - десять электронов.
Электронная формула атома – запись распределения электронов по орбиталям атома:
1s22s22p63s23p6...
Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы, например 3d5 - это 5 электронов на 3d-подуровне.
Например, электронная формула атома хлора 1s22s22p63s23p5.
Правило проскока электронов:
Если на d– подуровне атома хим.элем. (исходя из его положения в ПСХЭ) должно находиться 4 или 9 е, то с внешнего s – подуровня происходит «проскок» («провал») одного электрона, в результате чего на внешнем слое остается 1 электрон, а на d– подуровне становится 5 или 10 электронов, соответственно. Этот «проскок» можно объяснить более устойчивой полузавершенной (5е) или завершенной (10е) d–оболочкой. Такой «проскок» наблюдается у следующих элементов: Cr, Mo, Cu, Ag, Au.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
 2015-10-16
2015-10-16 4284
4284