Данный метод основан на представлении о степени окисления атома в веществе. Степень окисления - это условный заряд атома, найденный исходя из предположения, что все связи в веществе чисто ионные. Степень окисления обозначается арабской цифрой со знаком (+) или (-).
Ионной связи в чистом виде в природе не существует. Например, в кристаллическом хлориде натрия (NaCl), натрий имеет реальный заряд +0,8, а хлор (-0,8) заряда электрона по модулю. Отсюда следует, что степени окисления натрия (Na+) и хлора (Cl-) являются понятием формальным.
Тем не менее, метод электронного баланса в настоящее время широко используется, так как он наиболее прост и универсален. Практически единственным ограничением этого метода является то, что он позволяет уравнивать только полные схемы реакций.
Правила нахождения степеней окисления
Для применения метода электронного баланса необходимо знать степени окисления всех атомов в формулах веществ (исходных и продуктов реакции). Степени окисления находятся с использованием следующих правил:
1. Cтепень окисления атома в простом веществе равна нулю:
H 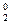 ; N
; N 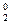 ; Mg
; Mg 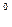 ; C
; C 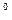 и т.д.
и т.д.
2. Сумма степеней окисления всех атомов в формульной единице вещества (молекуле) равна нулю.
K 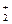 Cr
Cr 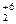 O
O 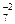 2 × (+1) + 2 × (+6) + 7 × (-2) = 0
2 × (+1) + 2 × (+6) + 7 × (-2) = 0
Чтобы воспользоваться этим правилом необходимо запомнить перечень химических элементов, атомы которых во всех (или почти во всех) их соединениях имеют одну и ту же степень окисления.
| Степень окисления атома элемента в соединениях | Исключения |
| Li+, Na+, K+, Rb+, Cs+, Fr+ | ¾¾¾ |
| Be+2, Mg+2, Ca+2, Sr+2, Ba+2, Ra+2 | ¾¾¾ |
| Al+3, Ga+3, Zn+3 | Al+, Ga+, Zn+ - очень редко |
| Ag+, Zn+2, Cd+2 | Ag+2 - очень редко |
| F- | ¾¾¾ |
| H+ | H- - в гидридах (NaH и т.п.) |
| O-2 | O- - в пероксидах (H2O2,, K2O2 и т.п.) O-1/2 - в надпероксидах (KO2 и т.п.) O-1/3 - в озонидах (KO3) O+, O+2 - во фторидах кислорода (O2F2, OF2) |
Возвратимся к приведенному выше примеру: K 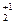 Cr
Cr 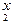 O
O 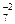 .
.
Cтепени окисления калия и кислорода найдены по таблице. Далее применяем правило электронейтральности молекулы: 2 × (+1) + 2 x + 7 × (-2) = 0. Отсюда: x = +6.
3. Степени окисления атомов в кислотных остатках такие же, как в соответствующих им кислотам. Это правило является следствием определения кислотного остатка: кислотный остаток - это часть молекулы кислоты, перешедшая в соль без изменений.
Пример: MnySxO  .
.
Вначале находим х. Кислотный остаток (сульфат) соответствует серной кислоте - H 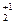 S+6O
S+6O  .
.
Теперь, по правилу электронейтральности молекулы можно найти степень окисления марганца: y + 6 + 4 (-2) = 0; y = +2.
Алгоритм применения метода электронного баланса
1. Написать схему реакции. Схема реакции - это условное химическое выражение, в котором слева указаны исходные вещества, справа - известные продукты реакции. Между правой и левой частями схемы ставится знак “стрелка”. Схема может быть полной (известны все продукты) и неполной (известна только часть продуктов). Метод электронного баланса позволяет работать только с полными схемами. Единственным веществом, которое можно не указывать в схеме является вода.
Пример: Cu + HNO3 ® Cu(NO3)2 + NO +....
(многоточие означает, что в правой и левой части окончательного уравнения может появиться вода).
2. Над каждым атомом в схеме поставить степени окисления:
Cu0 + H+1N+5O  ® Cu+2(N+5O
® Cu+2(N+5O  )2 + N+2O-2 +....
)2 + N+2O-2 +....
3. Найти атомы, изменившие свои степени окисления. Составить для них уравнения электронных переходов:
Cu0 + H+1N+5O  ® Cu+2(N+5O
® Cu+2(N+5O  )2 + N+2O-2 +....
)2 + N+2O-2 +....
Cu0 - 2 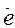 = Cu+2,
= Cu+2,
N+5 + 3 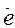 = N+2.
= N+2.
4. Сделать электронный баланс (подобрать коэффициенты, на которые нужно умножить уравнения электронных переходов, чтобы число электронов, ушедших от восстановителей, было равно количеству электронов, принятых окислителем).
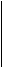 Cu0 - 2
Cu0 - 2 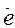 = Cu+2 3
= Cu+2 3
N+5 + 3 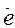 = N+2 2
= N+2 2
Из электронного баланса следует, что в левой части полученного уравнения на каждые 3 атома восстановителя (Cu+2) должно приходиться 2 атома окислителя (N+5). В правой части будущего уравнения на 3 атома Cu+2 должно приходиться 2 атома N+2.
5. В схеме реакции поставить первые коэффициенты в соответствии с электронным балансом (там, где это возможно!).
3Cu + HNO3 ® 3Cu(NO3)2 + 2NO +....
Обратите внимание: из четырех теоретически возможных коэффициентов указаны только три. Перед азотной кислотой коэффициент пока неизвестен, т.к. N+5 ведет себя сложным образом: с одной стороны принимает участие в ОВР (это учтено в электронном балансе), а с другой - переходит без изменений в нитрат меди (Сu(NO3)2) (это не учтено в электронном балансе, т.к. при этом степень окисления азота не меняется).
6. Уравнять по всем атомам, кроме водорода и кислорода. При этом произвольное изменение коэффициентов, полученных из электронного баланса недопустимо.
3Cu + 8 HNO3 ® 3Cu(NO3)2 + 2NO +....
7. Уравнять по водороду. Это делается только одним способом: добавлением соответствующего числа молекул воды в ту часть схемы, где водорода не хватает. В данном примере слева 8 атомов водорода, а справа - нуль. Молекула Н2О содержит 2 атома водорода:
3Cu + 8HNO3 ® 3Cu(NO3)2 + 2NO + 4H2O.
8. Полученное выражение должно быть уравнением ОВР, если до того не было допущено ошибки. Необходимо проверить данное уравнение по кислороду. Если справа и слева количество атомов кислорода одинаково, вместо “стрелки” ставим знак “равно” (это уравнение). Если по кислороду не сошлось, то следует повторить уравнивание, начиная с пункта 1.
Окончательное уравнение:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
 2015-04-30
2015-04-30 5722
5722








