Для того чтобы создать необходимую продукцию, получить энергию, сырье, человек находит и добывает природные ресурсы, перевозит их к местам переработки, производит из них предметы, которые в итоге поступает в пользование или в виде средств производства или в виде готовых изделий. Таким образом, человек вовлекает природные ресурсы в ресурсный цикл.
Под ресурсным циклом понимают совокупность превращений и пространственных перемещений определенного вещества или группы веществ на всех этапах использования его человеком. Слово „цикл” предполагает замкнутость процесса. Однако, ресурсный цикл, который иногда называют антропогенным круговоротом вещества, фактически незамкнут, т.к. использованные ресурсы не возвращаются в места изъятия.
На каждом этапе ресурсного цикла (добыча, заготовка, транспортировка, переработка) неизбежны потери вследствие либо особенностей технологии, либо субъективных причин, При добыче часть сырья остается в местах залегания, а в отвалы идет так называемая „пустая порода”. Если ресурс (например, каменный уголь) используется как топливо, то при его сгорании образуется большое количество золы, шлаков, оксидов, выбрасываемых в атмосферу или отвалы на поверхность Земли (например, терриконы, открытые карьеры).
Таким образом, получается, что загрязнение среды образуют... природные ресурсы. Не случайно существует афоризм: загрязнение среды – это природные ресурсы, оказавшиеся не на своем месте. Не умея пока использовать ресурсы полностью или многократно, человек вынужден добывать и перерабатывать в убыстряющемся темпе все новые и новые их порции, создавая проблему их же исчерпаемости.
Считается, что на всех этапах ресурсного цикла в окружающей среде рассеивается в среднем около 90 % добываемого сырья. При этом темпы прироста объема образующихся отходов составляют в настоящее время 5 – 10 % в год.
На каждую тонну производимого калийного удобрения образуется 3 – 4 т галитовых отходов, в основном содержащих хлорид натрия. На каждую тонну экстракционной фосфорной кислоты получается 4 – 5,5 т отходов в виде фосфогипса. Количество отходов на каждую тонну добываемого сырья составляет: нефть – 1, железная руда – 6, угля – 7, бокситы – 7 т.
Тепловые электростанции дают десятки миллионов тонн золы и шлаков в год. Так, Приднепровская ГРЭС выдает в отвалы 1 млн. т золы и 130 тыс. т шлаков ежегодно, для их складирования отведена площадь в 300 га, в настоящее время в отвалах скопилось более 30 млн. т золошлаков.
В настоящее время усилия ученых направлены на то, чтобы сделать ресурсный цикл замкнутым, т.е. с одной стороны, разрабатываются и совершенствуются процессы, связанные с извлечением и переработкой необходимых ресурсов, а с другой – обусловливается возвращение их в измененном виде в производство для повторного и неоднократного использования.
3.3. Классификация загрязнения окружающей среды
Загрязнение в узком смысле считается привнесение в какую-либо среду новых, не характерных для нее физических, химических и биологических агентов или превышение естественного среднемноголетнего уровня этих агентов в среде.
Непосредственными объектами загрязнения служат основные компоненты экотопа: атмосфера, вода, почва. Косвенными объектами загрязнения (жертвы загрязнения) являются составляющие биоценоза – растения, животные, микроорганизмы.
Различают источники загрязнения биосферы природные и промышленные (антропогенные).
Природные источники загрязнения вызваны естественными процессами (извержением вулканов, почвенная пыль, селевой поток и т.п.).
Промышленные источники загрязнения весьма разнообразны: среди них не только промышленные предприятия и теплоэнергетический комплекс, но и бытовые отходы, отходы животноводства, транспорта, а также химические вещества, специально вводимые человеком в экосистемы для защиты полезных продуцентов от вредителей, болезней и сорняков.
Среди ингредиентов загрязнения – тысячи химических соединений, особенно металлы и оксиды, токсические вещества, аэрозоли.
Классификация, приведенная на рис. 3.4., показывает, что все загрязнения могут быть объединены в две основные группы: материальные и энергетические.
К материальным загрязнениям относят неутилизированные химически инертные отходы производства (механические загрязнения) и все химически активные соединения и элементы, попадающие в биосферу и вступающие во взаимодействие с ее компонентами (химические загрязнения). Объединение химических и механических загрязнений в одну группу обусловлено тем, что большая часть этих веществ оказывает на окружающую природную среду оба рода воздействия. Биологические загрязнения – микроорганизмы и продукты их жизнедеятельности, появляющиеся в большом количестве в связи с массовым их размножением на антропогенных субстратах или средах, измененных в ходе хозяйственной деятельности человека. К энергетическим загрязнениям относят все виды 

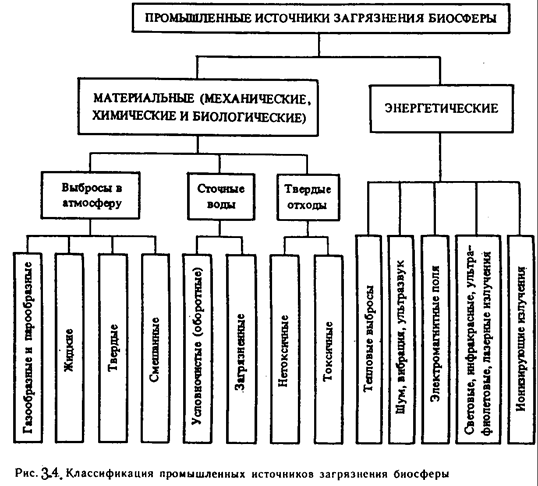 |
энергии.
Химические загрязнения – наиболее опасные виды загрязнений, так как они вызывают различного рода изменения в биосфере, а следовательно, могут воздействовать и на организм человека.
В основу классификации материальных загрязнений положено их агрегатное состояние, токсичность и воздействие на живые организмы.
По характеру воздействия на живые организмы загрязнения подразделяют на пять групп:
1) общесоматические, вызывающие отравление всего организма (оксид углерода, ртуть, цианистые соединения, свинец, бензол, мышьяк и его соединения и др.);
2) раздражающие, вызывающие раздражение дыхательного тракта и слизистых оболочек (хлор, аммиак, диоксид серы, оксиды азота, озон, ацетон и др.);
3) сенсибилизирующие, действующие как аллергены (формальдегид, различные растворители и лаки на основе нитро- и нитрозосоединений и др.);
4) канцерогенные, вызывающие злокачественные опухоли (3,4-бензпирен, некоторые полициклические ароматические углеводороды, никель и его соединения, диоксины, амины, оксиды хрома, асбест, радон и др.);
5) мутагенные, приводящие к изменению наследственной информации (полихлордифенилы, свинец, марганец, радий, уран и др.).
Загрязнения энергетические подразделяют на:
· тепловое, возникающее в результате повышения температуры среды главным образом в связи с промышленными выбросами нагретого воздуха, отходящих газов и воды;
· световое – нарушение естественной освещенности местности в результате воздействия искусственных источников света, приводящее к аномалиям в жизни растений и животных;
· шумовое, образующееся в результате увеличения интенсивности шума сверх природного уровня;
· электромагнитное, появляющееся в результате изменения электромагнитных свойств среды (электропередачи, радио и ТВ, работы некоторых промышленных установок), приводящее к глобальным и местным геофизическим аномалиям и изменениям в тонких биологических структурах;
· радиоактивное, связанное с превышением естественного уровня содержания в среде радиоактивных веществ.
Радиоактивные отходы могут быть одновременно материальными и энергетическими.
Загрязнение среды - сложный многообразный процесс. Отходы производств оказываются обычно там где, их раньше не было. Многие из них химически активны и способны взаимодействовать с молекулами, входящими в состав тканей живого организма. Понятно, что такие вещества оказываются ядами по отношению ко всему живому.
3.4. Загрязнение атмосферы
Атмосфера – внешняя оболочка биосферы. Масса ее ничтожна – всего лишь одна миллионная массы Земли. Однако роль атмосферы во всех природных процессах огромна. Наличие вокруг земного шара атмосферы определяет общий тепловой режим поверхности нашей планеты, защищает ее от вредного космического излучения и УФ-излучения Солнца. Циркуляция атмосферы влияет на местные климатические условия, а через них – на режим рек, почвенно-растительный покров и на процессы рельефообразования.
3.4.1. Структура и состав атмосферы
Масса атмосферы составляет около 5,9 · 1015 т. Она имеет слоистое строение (рис.2.1.) и состоит из нескольких сфер, между которыми располагаются переходные слои – паузы.
Прилегающий к земной поверхности наиболее плотный слой воздуха называется тропосферой. Протяженность ее по высоте в средних широтах 10 - 12 км над уровнем моря, на полюсах 7 - 10, над экватором – 16-18 км. В тропосфере сосредоточено более 4/5 массы земной атмосферы. Температура воздуха в тропосфере по высоте уменьшается и колеблется от 40 до -50оС.
Выше тропосферы находится стратосфера протяженностью 40 км. Температура воздуха от границы тропосферы до высоты 30 км постоянная (около – 50оС), а затем повышается и на высоте 50 км достигает 10оС. В стратосфере под воздействием космического излучения и коротковолновой части УФ-излучения Солнца молекулы воздуха ионизируются, в результате чего образуется озон.
Стратопауза отделяет стратосферу от лежащей выше мезосферы. Выше мезосферы расположена термосфера (или ионосфера), для которой характерно непрерывное повышение температуры с увеличением высоты. На высоте 150 км температура достигает 200 – 240оС, на уровне 200км. – 500оС, а на высоте 500 - 600 км превышает 1500оС. В термосфере газы очень разряжены. Молекулы их движутся с большой скоростью, но редко сталкиваются между собой и поэтому не могут вызвать даже небольшого нагревания находящегося здесь тела.
Атмосфера состоит в основном из азота и кислорода. На высоте 110 – 120 км кислород почти весь становится атомарным. Предполагается, что выше 400 – 500 км и азот находится в атомарном состоянии. Кислородно-азотный состав сохраняется примерно до высоты 400 – 600 км. Выше 600 км в атмосфере начинает преобладать гелий примерно до высоты 1600 км, а выше 2000 – 3000 км преобладает водород.
Под действием солнечного излучения в атмосфере протекает множество реакций, в которых участвует азот, кислород, озон, оксид азота, диоксид углерода и пары воды. Ионизация происходит в основном на высоте 70 – 80 км. При этом отмечается отрицательные (N–, О–,СОЗ–,NО2–, NО3–) и положительные (N+, О+, О2+, Н+) ионы. Эти ионы образуют различные комплексы: NO+.N2; NO+.СО2; NO+.Н2; О2+.(Н2О).
3.4.2. Источники загрязнения атмосферы
Существует два главных источника загрязнения атмосферы: естественный и антропогенный.
Космическая пыль образуется из остатков сгоревших метеоритов при их прохождении в атмосфере. Ежегодно ее выпадает на Землю 2 – 5 млн. т. Природная пыль является постоянной составной частью земной атмосферы. Она представляет собой мельчайшие твердые взвешенные в воздухе частицы радиусом 10–4–10–3см. Частицы природной пыли имеют органическое и неорганическое происхождение и образуются в результате разрушения и выветривания горных пород и почвы, вулканических извержений, лесных и степных пожаров, испарения с поверхности морей. Одним из источником пыли в нижних соях атмосферы является безводные пустыни и степи.
Атмосферный воздух над океаном включает мельчайшие кристаллы солей магния, натрия, калия, кальция, образующиеся в результате высыхания в воздухе брызг воды. Как правило, естественное загрязнение не угрожает отрицательными последствиями для биогеоценозов и обитающих в них живых организмов, хотя кратковременные последствия возможны.
Атмосферная пыль способствует конденсации водяных паров, а следовательно, и образованию осадков. Кроме того, она поглощает прямую солнечную радиацию и защищает организмы от солнечного излучения.
Источниками антропогенного поступления в атмосферу примесей являются теплоэнергетика, промышленность, нефте- и газопереработка, транспорт, испытания термоядерного оружия. Каждый из этих источников (и каждая отрасль производства) связан с выделением специфических примесей, состав которых насчитывает десятки тысяч веществ, выявление и идентификация которых иногда затруднительна. Однако наиболее обычные загрязняющие вещества, поступающие в атмосферу в большом количестве и называемые поэтому многотоннажными, сравнительно немногочисленны. Наиболее распространенные выбросы промышленности следующие: зола, пыль, диоксид и триоксид серы, оксид цинка, силикаты, хлорид свинца; сероводород, меркаптан; альдегиды, углеводороды, смолы; оксид и диоксид азота, аммиак, озон, оксид и диоксид углерода; фтороводород, хлороводород, кремнефторид натрия, радиоактивные газы, аэрозоли.
Чрезвычайно опасным источником загрязнения атмосферы является ядерное оружие. Суммарная мощность мировых запасов ядерного оружия оценивается в 12 тыс. Мт. Энергия, которая может выделиться при взрыве всего имеющегося этого оружия, оказалась бы равна энергии, получаемой нашей планетой от Солнца за 5 мин.
По ориентировочным расчетам специалистов, вследствие пожаров, вызванных ядерными взрывами, может образоваться 300 – 900 млн. т оксида углерода. Сейчас его в атмосфере содержится 4 млрд. т. Таким образом, концентрация СО увеличится в среднем в 1,5 раза, а в некоторых местах станет опасной для здоровья и жизни людей.
Количество оксидов азота, которое может в этом случае образоваться, достигнет величины 30 млн. т, что приблизительно равно половине ежегодных выбросов в атмосферу автомобилями и промышленными предприятиями. Оксиды азота, попавшие после взрыва в стратосферу, приведут к разрушению озонового слоя на 20 – 30 %.
Исключительно опасно радиоактивное загрязнение среды, которое может оставаться в атмосфере многие месяцы и годы.
Серьезным предупреждением человечеству стала авария на Чернобыльской АЭС в апреле 1986 г. К причинам аварии можно отнести и конкретные физические характеристики реактора, и грубые нарушения правил эксплуатации персоналом АЭС, и просчеты проектировщиков. Реактор 4-го энергоблока станции выбросил в атмосферу 50 т испарившегося топлива. Еще около 70 т топлива было выброшено с периферийных участков активной зоны боковыми „лучами” взрыва. Активность выброшенного топлива достигла 15 – 20 тыс. р/ч. Примерно 50 т ядерного топлива и 800 т реакторного графита остались в реакторе, причем графит выгорел в последующие дни, внеся дополнительный вклад в радиоактивные осадки. Для сравнения: масса радиоактивных веществ, которые образовались при взрыве атомной бомбы над Хиросимой, составила 4,5 т.
Последствия чернобыльской аварии оказались очень тяжелыми. Во время аварии погибло 2 человека, 29 умерли позднее от радиационного поражения, 135 тыс. человек эвакуированы из 30-километровой зоны. Испарившееся топливо (диоксид урана, высокорадиоактивные радионуклиды йода-131, плутония-239, нептуния-139, цезия-137, стронция-90 и др.) вызвало радиоактивное загрязнение многих регионов Белоруссии, России, Украины.
Главными источниками загрязнения атмосферного воздуха являются энергетика, промышленность и автотранспорт, при этом наибольшие по объему выбросы (в %) распределяются между ними следующим образом:
· оксид углерода: автотранспорт –84,промышленность –12, энергетика-4;
· окислы азота: энергетика –53, автотранспорт – 42, промышленность – 5;
· диоксид серы: энергетика-70, промышленность- 28, автотранспорт-2;
· углеводороды: промышленность –37, автотранспорт – 63.
Наибольшее количество загрязняющих атмосферу веществ выбрасывается с выхлопными газами автомобилей. В настоящее время в мире насчитывается свыше 950 млн. автомобилей, выхлопные газы которых содержат примерно 200 токсичных веществ, в том числе канцерогенные углеводороды и тетраэтилсвинец. Однако количество основных компонентов значительно меньше (табл.3.1.)
Таблица 3.1. Содержание загрязняющих веществ в выхлопных газах
двигателей
| Компоненты (загрязняющие вещества) | Единицы измерения | Содержание в выхлопных газах двигателей | |
| карбюраторных | дизельных | ||
| Диоксид углерода | % | 5 – 12 | 1,0 – 10 |
| Монооксид углерода | % | 0,5 – 12 | 0,01 – 0,5 |
| Оксиды азота | % | 0,0 – 0,8 | 0,0002 – 0,5 |
| Углеводороды неканцерогенные (этан, метан, этилен, бензол, ацетилен, толуол, м-ксилол и др.) | % | 0,2 – 0,3 | 0,009 – 0,5 |
| Альдегиды (формальдегид, акролеин, ацеталдьдегид) | % | 0,0 – 0,2 | 0,001 – 0,009 |
| Сажа | г / м3 | 0,0 – 0,4 | 0,01 – 1,1 |
| Бензпирен | мкг / м3 | до 10 – 20 | до 10 |
Как видно из таблицы, бензиновые двигатели выбрасывают больше несгоревших углеводородов и продуктов их неполного окисления (оксид углерода и альдегидов), чем дизели. Каждая машина с бензиновым двигателем за пройденные 15 тыс. км потребляет 4350 кг кислорода, а выбрасывает 3250 кг диоксида углерода, 530 кг оксида углерода, 93 кг углеводородов, 27 кг оксидов азота, 0,5 кг свинца, 0,2 г бензпирена.
Тепловые электростанции выделяют в атмосферу газы, содержащие оксиды серы и азота, золу, металлы; предприятия черной металлургии – газы, включающие пыль, оксиды серы и металлов. На 1 т передельного чугуна приходится 4,5 кг пыли, 2,7 кг SO2, 0,1 – 0,5 кг марганца, а также соединения мышьяка, фосфора, сурьмы, свинца, ртути, редких металлов, смолистые вещества.
Агломерационные фабрики выбрасывают пыль и диоксид серы (190 кг SO2 на 1 т руды). При производстве 1 т мартеновской стали выделяется 3000 – 4000 м3 газов (с концентрацией пыли в среднем 0,5 г/м3), 60 кг СО и 3 кг SO2. Коксохимические заводы загрязняют атмосферу пылью и смесью летучих соединений, среди которых особенно токсичен фенол, бензпирен, сероводород.
Предприятия цветной металлургии выбрасывают запыленные газы, содержащие диоксид серы, фтористые газы и металлы. Из тонны пыли, выделяемой в атмосферу при плавке медных руд, можно извлечь до 100 кг меди и немного меньше свинца и цинка.
Выбросы нефтеперерабатывающей и нефтедобывающей промышленности в атмосферу содержат углеводороды (в том числе стирол, дивинил, толуол, изопрен), сероводород и другие дурнопахнущие газы.
Заводы промышленности строительных материалов выбрасывают пыль, фториды, диоксиды серы и азота.
Наибольшее загрязнение атмосферного воздуха приходится на долю оксидов углерода, соединений серы и азота, углеводородов и промышленной пыли. За год в атмосферу Земли выбрасывается 800 млн. т оксида углерода, более 23 млрд. т диоксида углерода, 275 млн. т диоксида серы, 120 млн. т оксидов азота, свыше 700 млн. т пыли, 120 млн. т золы, более 500 млн. т различных углеводородов, фреонов – 1,4 млн. т.
Прогрессирующее насыщение биосферы тяжелыми металлами – одно из наиболее существенных глобальных последствий научно-технической революции. Подсчитано, что за всю историю человеческого общества выплавлено около 20 млрд. т железа. Количество железа в составе сооружений, машин, оборудования и т.д. сейчас исчисляется приблизительно в 6 млрд. т. Следовательно, примерно 14 млрд. т рассеяно в окружающей среде. Другие металлы рассеиваются еще больше. Например, рассеивание ртути и свинца составляет 80 – 90 % от годового производства. При сжигании угля с золой и отходящими газами некоторых элементов в окружающую среду поступает больше чем добыча из недр: магния – в 1,5 раза, молибдена – в 3 раза, мышьяка – в 7, урана, титана – в 10, алюминия, йода, кобальта – в 15, ртути – в 50 раз, лития, ванадия, стронция, бериллия, циркония – в сотни раз, галлия, германия – в тысячи раз, иттрия – в десятки тысяч раз.
Предприятия химической промышленности загрязняют атмосферу пылью, содержащей неорганические и органические вещества, и различными газами (табл. 3.2.).
Таблица 3.2. Наиболее характерные выбросы в атмосферу основных
производств химической промышленности
| Производство | Компоненты выбросов в атмосферу |
| Азотной кислоты | NO, NO2, NH3 |
| Серной кислоты (нитрозной и контактной) | NO, NO2, SO2, Н2SO4 |
| Соляной кислоты | НСℓ, Сℓ2 |
| Фосфора и фосфорной кислоты | Р2О5, Н3РО4, НF, Са5F(PO4) (пыль) |
| Сложных удобрений | NO, NO2, NH3, HF, H2SO4, P2O5,НNO3 |
| Карбамида | NH3, СО, (NН3) 2СО (пыль) |
| Аммонийной селитры | СО, NН3, НNО3, NH4NO3 (пыль) |
| Суперфосфата | Н2SO4, HF, пыль суперфосфата |
| Жидкого хлора | НСℓ, Сℓ2, Hq |
| Полихлорвиниловой смолы | Нq, HqCℓ2, Н3 |
| Аммиака | NH3, СО |
| Метанола | СН3ОН, СО |
| Капролактама | NO, NO2, SO2, H2S,СО |
| Диоксида титана | Ильменит, ТiO2, FeO, Fe2O3 |
| Карбофоса | SO2, Р2О5, Н2S, пыль карбофоса |
3.4.3. Перенос загрязнений в атмосфере
Количество солнечной энергии, поступающей на Землю и отражаемой от нее в атмосферу, в различных широтах неодинаково. В результате этого атмосфера в разных районах земного шара нагревается неравномерно. Особенно большие различия температуры у поверхности наблюдается между полярными и экваториальными областями. Эта неравномерность нагревания служит главной причиной общей циркуляции атмосферы, представляющей собой сложную систему воздушных течений над Землей. Благодаря такой циркуляции усредняется состав основных компонентов воздуха, а воздушные течения переносят водяной пар, а также загрязнения от океанов в континентальные районы.
Кроме крупномасштабных течений в нижних слоях атмосферы возникают многочисленные местные циркуляции, связанные с особенностями нагревания атмосферы в отдельных районах. Вследствие образования различных течений в атмосфере перемещаются большие массы воздуха и на значительные расстояния перемещаются соединения, выделяемые теми или иными источниками на поверхности Земли.
Так, известный инсектицид ДДТ обнаружен в Антарктиде в тканях пингвинов, где его никогда не применяли.
Оксиды серы и азота могут задерживаться в атмосфере до 15 дней. За это время они переносятся ветром на расстояние более 1000 км, и одни страны становятся объектом постоянного загрязнения со стороны других. Так, Норвегия получает из Центральной Европы и Англии 250 тыс. т диоксида серы ежегодно, в то время как промышленность страны выделяет сернистого ангидрида в 2 раза меньше. Промышленность США „отправляет” в Канаду ежегодно около 2 млн. т сернистого газа.
3.4.4 Химические превращения веществ в атмосфере
Загрязняющие атмосферу вещества подразделяют на первичные и вторичные. Первичные – это те, которые содержатся непосредственно в выбросах предприятий и поступают с ними от различных источников, а вторичные являются продуктами трансформации первичных, или так называемого встречного синтеза, причем эти продукты во многих случаях значительно более опасны, чем первичные вещества.
Поступившие а атмосферу химические соединения подвергаются самым разнообразным превращениям в результате реакций между собой, с уже содержащимися в воздухе веществами, включая пары воды, а также под воздействием солнечных лучей. Превращения зависят и от времени пребывания веществ в атмосфере, под которым понимают промежуток времени между поступлением компонента в атмосферу и удалением (стоком) из нее. Наиболее значимы превращения под действием солнечного излучения. В общем случае при поглощении кванта света с частотой ν могут происходить следующие процессы:
образование электронно-возбужденных молекул: А + hν ® А*;
дезактивация за счет флуоресценции: А* ® А + hν ΄;
дезактивация (тушение) за счет соударения с другими молекулами
А*+ Q ® A + Q΄;
диссоциация: А*® В + С.
Для атмосферной фотохимии наибольший интерес представляют явления фотохимической диссоциации электронно-возбужденных молекул А*. Возбужденное состояние весьма нестабильно, так что вслед за появлением А* быстро следует реакция образования продуктов В и С. Один или оба из них могут быть очень активными и приводят к началу цепи реакций, в результате которых возникают нежелательные соединения, в том числе служащие основой фотохимического смога.
Химические превращения в тропосфере и стратосфере инициируются, главным образом, продуктами фотолиза таких молекул, как О3, О2, Н2О, NO2 и N2O. Важнейшим компонентом, определяющим химию стратосферы, является озон. Образование атомарного кислорода в атмосфере (выше 80 км) происходит по следующей реакции: О2 + hν ® 2O. Атомарный кислород участвует в реакциях возникновения О2 и О3. Озон получается по уравнению: О + О2 + М ® О3 + М, где М - третье вещество, принимающее избыток энергии.
Озон подвергается химической диссоциации: О3 + hν ® О2 + О.
В атмосфере присутствуют пять азотосодержащих газов: N2, NH3, NO, NO2, N2O. В конденсированной фазе азот присутствует в форме иона аммония (NH4) и нитратного иона (NO3). В атмосфере городов наблюдается значительное количество органических нитратов.
Оксиды азота антропогенного происхождения в большинстве случаев попадают в атмосферу в виде NO. Затем происходят следующие реакции:
2NO + O2 ® 2NO2, O + O2 + M ® O3 + M,
NO2 + hν ® NO + O, O3 + NO ® NO2 + O2.
Возможны и другие многочисленные реакции с участием веществ, содержащих азот и кислород:
O + NO2 ® NO + O2, NO3 + NO ® 2NO2,
O + NO2 + M ® NO3 + M, NO2 + O3 ® NO3 + O2,
O + NO + M ® NO2 + M, NO3 + NO2 + M ® N2O5 + M.
Цикл соединений азота в тропосфере дополняется образованием азотной кислоты: 4NO2 + H2O + О2 ® 4НNО3.
Диоксид азота может гидролизоваться также в газовой фазе:
3NО2 + Н2О ® 2НNО3 + NО.
Выделяющаяся по этим реакциям азотная кислота далее может реагировать с ионами металлов, образуя нитраты.
Атомарный озон и кислород способны вступать в соединение с различными органическими веществами, в результате чего получаются органические и неорганические свободные радикалы. Для олефиновых углеводородов возможна следующая подобная реакция: О3 + RCH = CHR ® RCHO + RO* + HCO*, где RO* и HCO* - свободные радикалы.
Полученный альдегид RCHO может подвергаться фотодиссоциации по реакции: RCHO + hν ® R + HCO*. Кроме альдегидов фотохимически активны также кетоны, пероксиды и ацилнитраты, которые при поглощении солнечной радиации также образуют свободные радикалы.
Свободные радикалы с молекулярным кислородом образуют пероксидные радикалы (ROO*), т.е. R* + O2 ® ROO*.
Пероксидные радикалы способны окислять NO в NO2 по реакции
ROO* + NO ® NO2 + RO*.
Возможно также возникновение озона по реакции пероксидных радикалов с кислородом, т.е.
ROO* + O2 ® RO* + O3.
Возникают и другие реакции:
RCO2 + NO ® RCO* + NO2,
RCO* + O2 ® RCO3*,
 2015-10-16
2015-10-16 375
375








