1. чем важнее роль белка в процессах жизнедеятельности, тем разнообразнее его первичная структура (и наоборот, чем примитивнее функции, тем монотоннее его первичная структура). Например, в инсулине 16 различных аминокислот, а всего – 51 аминокислотный остаток, и свойства и функции инсулина весьма разнообразны, в то время, как в структурном белке коллагене 1300 остатков представлены всего 8 аминокислотами.
2. чем важнее роль белка в процессах жизнедеятельности, тем больше сходства в первичной структуре гомологичных белков различных видов организмов. Так у всех животных цепь В инсулина одинакова, а цепь А отличается только в трёх аминокислотных остатках в положениях 8, 9, 10.
Вторичная структура белка образуется в результате стабилизации первичной структуры. Под вторичной структурой подразумевают конфигурацию полипептидной цепи, т.е. способ ее складывания, упаковки. Вторичная структура может быть неорганизованной и организованной. Наиболее изучены две конфигурации полипептидной цепи: a-спираль и β-структура (рис. 2). Вторичная структура удерживается за счёт образования водородных связей между остатками карбоксильной и аминогрупп, образующие пептидные связи.
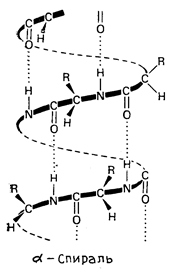
α-спираль β-структура
Рис. 2. Вторичная структура белков
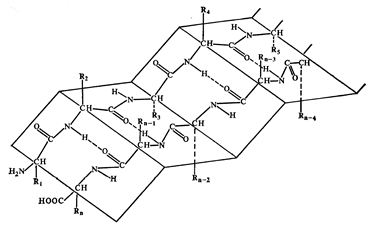
Под третичной структурой (нативной) понимают пространственную ориентацию полипептидной цепи в определённом объёме. Третичная структура называется так же конформацией – термодинамически наиболее выгодной формой молекулы. По современным представлениям, третичная структура формируется после завершения синтеза белка совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой.
Рис. 3. Третичная структура белка
Основной движущей силой в возникновении трёхмерной структуры является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в сторону воды.
При формировании нативной структуры белка образуются
В формировании и стабилизации пространственной конформации принимают участие силы различной природы: ковалентные дисульфидные, образованные тиольными группами остатков цистеина, и слабые нековалентные связи – водородные, электростатические и гидрофобные взаимодействия, межмолекулярные ван-дер-ваальсовы силы.

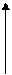

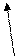

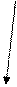
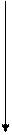

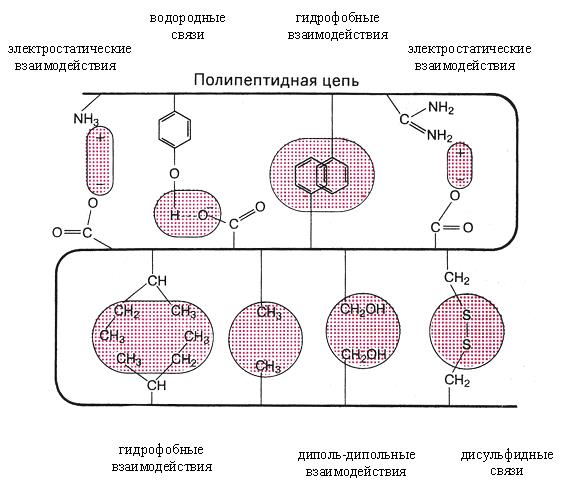
Рис. 4. Связи, характерные для третичной структуры
Одним из уникальных свойств белков является их способность при выполнении своих функций высокоизбирательно (специфично) связываться с различными молекулами органического и неорганического происхождения, называемыми лигандами. Эта способность связана с мозаичностью третичной структуры и образованием за счёт мозаичности центров связывания, к которым и присоединяются лиганды. При этом образуются белково-лигандные комплексы:
Для таких комплексов характерны:
1. высокая степень сродства, т.е. взаимодействие идёт очень быстро,
2. высокая избирательность связывания (специфичность),
3. быстрая насыщаемость,
4. обратимость связывания.
Образование белково-лигандных комплексов происходит по принципу комплиментарности, точного пространственного соответствия белка и лиганда. Силы, обеспечивающие связывание – гидрофобные, электростатические взаимодействия, водородные связи.
Природными лигандами могут быть практически любые органические и неорганические вещества – металлы, газы, витамины, белки и др. При выполнении любой функции белков происходит образование белково-лигандного комплекса, например:
1. каталитическое взаимодействие
Е + S ↔ ЕS
фермент субстрат
2. гормональное взаимодействие
РБ + Г ↔ РБГ
рецепторный гормон
белок
3. защитное взаимодействие
Ат + Аг ↔ АтАг
антитело антиген
актин + миозин ↔ актомиозин
 2015-10-16
2015-10-16 4594
4594
