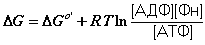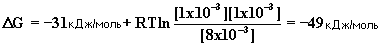Вычислим изменение свободной энергии одной из важнейших реакций в биохимии.
- гидролиза ATФ
ATФ-4 + H2O Û AДФ-3 + HPO4-2 + H+
Свободная энергия для этой реакции 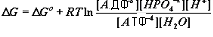
Проведем некоторые преобразования в формуле
DG =DGo + RT ln{([AДФ3-][HPO42-]) / ([ATФ4-])} + RT ln{[H+]/[H2O]}
Из формулы видно, что pH раствора, в котором проводится реакция, оказывает влияние на равновесие реакции. Учитывая факт, что все реакции в клетке проходят в водной среде и что [H2O] и [H +] (RT ln{[H+] / [H2O]}) по существу постоянны, эти значения при вычислении свободной энергии, включаются в уравнение свободной энергии. При этом вводится новое стандартное изменение свободной энергии DGo':
DGo' = DGo + RTln{[H+]/[H2O]}
Для дальнейшего упрощения принимаем:
- AДФ вместо AДФ-3
- ATФ, вместо ATФ-4
- Фн, вместо HPO4-2.
И получаем уравнение изменения свободной энергии для этой реакции. 
Теперь мы можем приступить к конкретным вычислениям.
1. Если равновесная концентрация АТФ = 1x10-7 M, AДФ = 0.165 M и Фн = 0.1 M, какова константа равновесия и DGo' для гидролиза АТФ при 37oC?.
- Используем данные для расчета Keq
-
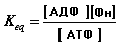
-
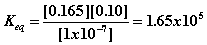
- Используем величину Keq для расчета DGo'
o DGo' = -RTln Keq
o DGo'= - 8.314x10-3кДж/моль x 310o x ln (1.65 x 105)
o DGo' = -31 кДж/моль.
2. Какова свободная энергия гидролиза ATФ при типичных для клетки условиях: температура 37oC, концентрации АТФ= 8 x 10-3 M, AДФ = 1 x 10-3 M, и Фн = 8 x 10-3 M.?
Примечание:
1.Принимаемые за стандартные, концентрации реагирующих веществ в 1М не встречаются в биологических системах. Поэтому следует сделать следующие замечания по поводу используемых обозначений изменения свободной энергии:
DG - Изменение общей свободной энергии для реакции при любых состояниях
DGo - Свободная энергия при нормальных условиях (все концентрации 1M)
DGo', Изменение свободной энергии при стандартных биологических состояниях (все концентрации 1M, [H2O] = постоянно, и pH = 7.0)
Положительное DG данной реакции может указывать на невозможность самопроизвольного ее протекания, но условия в клетке могут сделать общее DG для реакции отрицательной.
2. DG и только DG (!) определяет, является ли данная реакция термодинамически благоприятной. ЗнакиDGo илиDGo' не определяют направление продолжения реакции.
DG зависит от температуры (DG = D H - T D S). Это может быть важным фактором для данной реакции, встречающейся у различных организмов, живущих в различных температурных условиях.
 2015-10-16
2015-10-16 1269
1269