Чтобы термодинамические данные можно было использовать при химических расчетах, необходимы какие-то состояния элементов или соединений принять за стандартные. Для реакций, протекающих в растворе, таким условием является 1 М концентрация реагирующих веществ. Стандартная свободная энергия обозначается символом:
Go
Свободная энергия любого компонента реакции (Х) связана со стандартной свободной энергией следующим образом:
G = Go + RTln[X] (6)
Из уравнения 6 можно увидеть, что если компонент X, или любой другой компонент присутствует в концентрации 1M, то ln [1] равен нулю и:
G = Go (7)
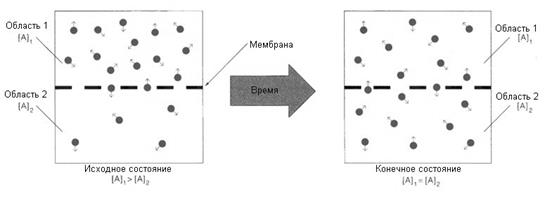
Полезность вычислений свободной энергии может быть показана при рассмотрении диффузии вещества через мембрану. Рассмотрим перемещающуюся молекулу с одной стороны мембраны, через которую она может пройти (область 1) на другую (область 2). Свободная энергия движущейся A из области 1 описывается
DG1 = Go + RTln[А]1
Свободная энергия движущейся A в область 2
DG2 = Go + RTln[А]2
Итого,
 |
DG = DG1 + DG2 =RT (ln[A]2+ ln[A]1)= RTln{[A]2/[A]1}
Рис 4-3. Схема процесса диффузии частиц через мембрану по градиенту концентрации.
Таким образом, если концентрация в области 2 более низкая, чем в области 1, значение DG отрицательно и процесс термодинамически благоприятен. С другой стороны, если концентрация в области 2 выше чем в области 1, DG положительна и процесс термодинамически не благоприятен.
Изменение свободной энергии и константа равновесия .
Если свободная энергия - функция состояния, то DG реакции зависит лишь от свободной энергии исходного состояния (реагентов) и свободной энергии конечного состояния (продуктов):
DG = G(продукты) - G(реагенты)
Возьмем реакцию aA + bB <=> cC + dD, где a - число молей компонента A, b - число молей компонента B, и т.д.
Используя вышеприведенное уравнение и обозначив условия стандартного состояния одним символом DGo, получаем
DG = DGo + RT ln {([C]c[D]d)/([A]a[B]b)}
Упрощая (и запомнив, что концентрация продуктов и реагентов должны выражаться в одинаковых величинах) получаем следующее общее уравнение для определения DG при любых состояниях, где DGo - изменение свободной энергии для стандартного состояния (1M):
DG = DGo + RT ln{[продукты]/[реагенты]}
При равновесии константа равновесия K для реакции определяется как
K = {([C]c[D]d)/([A]a[B]b)}
Отметив, что при равновесии D G = 0, получаем
0 = DGo + RT ln K,
-DGo = RT lnK, или 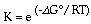
 2015-10-16
2015-10-16 915
915








