Первый закон термодинамики показывает, что энергия вселенной не исчезает и не возникает, она постоянна. Это закон постоянства энергии во вселенной. Однако это не означает, что формы энергии не могут изменяться. Действительно, химическая энергия молекулы может быть преобразована в тепловую, электрическую или механическую энергию. Если системе подвести определенное количество теплоты (Q), то часть ее будет использована на выполнение работы (А), а часть на изменение внутренней энергии системы:
DЕ=Екон. – Енач. =Q-А или Q=DE+А (1)
Q соответствует теплу, поглощенному системой, а А – работе, выполненной системой над окружающей средой. Если Q отрицательно, тепло покидает систему, а если Q положительно - тепло поглощается системой. Наоборот, если А отрицательна - совершается работа над системой, если А положительно, система совершает работу над окружающей средой.
Энергия, теплота и работа измеряются в одних и тех же единицах –калории (кал) или килокалории (Кал), а в системе СИ – джоуль (Дж) или килоджоуль (кДж). Прямым способом измерения Е является измерение поглощаемой энергии при сжигании вещества в калориметре при постоянном объеме. В этих условиях Q = DE. (см рис -2а.). Большинство биохимических реакций протекают чаще при постоянном давлении. Для количественной оценки реакций в таких условиях более удобной оказалась другая функция состояния - энтальпия или теплосодержание (H).(греч enthaltpein –теплота в)
H=Е+PV где V- объем системы, Р – давление.
При постоянном давлении, DH = D E + P D V. Тот же самый результат может быть получен из формулы (1):
DE = Q-А, где
Q = DE + А, но А = PDV если V изменяется при постоянном P, значит
Q = DE + PDV
Таким образом, когда теплота реакции измеряется при постоянном давлении, она соответствует реальному значению DH. (см рис -2.б). Сжигая пищевые продукты при постоянном давлении, рассчитывают их калорийность. Калорийностью пищевых продуктов называют скорректированную величину энтальпии сгорания, взятую с обратным знаком.
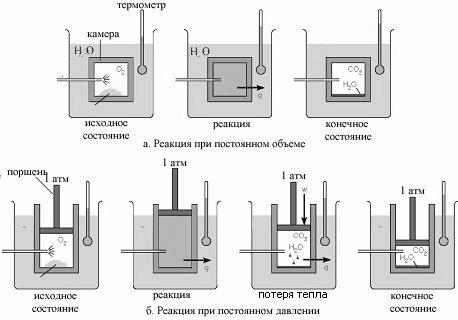
Рис.4-2. Изменения теплоты и работы в реакциях, протекающих при постоянном объеме (а) и постоянном давлении
Функции состояния, подобные DH и DE, не зависят от пути, по которому проходит реакция. Эти функции относятся к разности между начальными и конечными состояниями реакции. Однако, теплота (Q) и работа (А) - являются независимыми термодинамическими параметрами и их значения зависят от пути реакции.
Первый закон термодинамики дает возможность рассчитать изменения энергии при разных состояниях системы, позволяет оценить процессы перехода одного вида энергии в другой, но не дает ответа на вопрос о направлении процессов и возможности их спонтанного протекания.
 2015-10-16
2015-10-16 468
468








