Реакционная способность белковой молекулы зависит от строения аминокислот, входящих в её состав.
Основные различия в строении белковых молекул
1. По количеству аминокислот
2. По соотношению количества различных аминокислот. Например, в белке соединительной ткани коллагене 33% от общего количества аминокислот составляет глицин, а в молекуле белкового гормона инсулина, вырабатываемого в поджелудочной железе, содержание глицина гораздо меньше – всего 8%.
3. Различная последовательность чередования аминокислот. Это означает, что даже при одинаковом соотношении разных аминокислот в каких-нибудь двух белках порядок их расположения этих аминокислот различен, то это будут разные белки.
4. Количество полипептидных цепей в различных белках может варьировать от 1 до 12, но если больше единицы, то обычно четное (2, 4, 6 и т.п.)
5. По наличию небелкового компонента, который называется «простетическая группа».
II. Физико-химические свойства аминокислот, входящих в состав белков.
Все белки дают ряд характерных реакций:
1. Реакция Ван-Сляйка (с азотистой кислотой)
R-CH-COOH + HNO2 = R-CH-COOH + N2 + H2O
½ ½
NH2 OH
оксикислота
Эта реакция лежит в основе количественного определения белка по количеству выделившегося азота.
2. Взаимодействие со щелочами.
R-CH-COOH + NаOH = R-CH-COONа + H2O
½ ½
NH2 NH2
3. Реакция Зёренсена (с формальдегидом)
R-CH-COOH + H-C=O = R-CH-COOН + H2O
½ ½ ½
NH2 H N=СH2
Образовавшееся соединение оттитровывают щелочью. По количеству щелочи можно определить содержание аминокислот или белка. Эта реакция лежит в основе формольного титрования
R-CH-COOH + NаOH = R-CH-COONа + H2O
½ ½
N=СH2 N=СH2
4. Реакция этерификации (со спиртом)
R-CH-COOH + С2Н5OH = R-CH-COO С2Н5 + H2O
½ ½
NH2 NH2
5. Реакция с нингидрином
СН O O СН
/ \\ êê êê // \ O


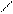
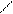

 HC C ¾ C OH HO C ¾ C CH //
HC C ¾ C OH HO C ¾ C CH //
êê ½ C + R-CH-COOH ® C ½ êê + CO2 + R- C

 HC C ¾ C OH ½ H C ¾ C CH \
HC C ¾ C OH ½ H C ¾ C CH \
\ // êê OH êê \\ / H
СН O Аминокислота O CH альдегид
Нингидрин
СН O СН O O СН
/ \\ êê / \\ êê êê // \


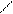

 HC C ¾ C OH NH3 HC C ¾ C C ¾ C CH
HC C ¾ C OH NH3 HC C ¾ C C ¾ C CH


 êê ½ C ® êê ½ C H ¾ N = C ½ êê+ 3H2O + H+
êê ½ C ® êê ½ C H ¾ N = C ½ êê+ 3H2O + H+
 HC C ¾ C OH HC C ¾ C C ¾ C CH
HC C ¾ C OH HC C ¾ C C ¾ C CH
\ // êê \ // ½ êê \\ /
СН O СН O- O CH
Продукт с сине-фиолетовой окраской
7. Реакция Майера (реакция меланоидинообразования)
Меланоидины – окрашенные соединения, образующиеся в результате взаимодействия белков с восстановленными сахарами и альдегидами при вы-
сокой температуре. Эта реакция обуславливает цвет корки хлеба, цвет пива.
III. Классификация аминокислот
| АМИНОКИСЛОТЫ | |
| |
| Ациклические (неразветвленные) | Циклические (разветвленные) |
| 1. Моноаминомонокарбоновые | 5. Гомоциклические |
| 2. Моноаминодикарбоновые | 6. Гетероциклические |
| 3. Диаминомонокарбоновые | |
| 4. Диаминодикарбоновые |
1. Моноаминомонокарбоновые
Гликокол (глицин) Аланин
CH2-COOH H3C -CH-COOН
½ ½
NH2 NH2
1.1. Валин 1.2. Лейцин
H3C-CH-CH-COOH H3C-CH-СH2 -CH-COOН
½ ½ ½ ½
CH3 NH2 CH3 NH2
1.3. Изолейцин 1.4. Метионин
H3C- СH2-CH-СH2 -CH-COOН H3C-S-(СH2)2 -CH-COOН
½ ½ ½
CH3 NH2 NH2
1.5. Треонин
H3C-CH-CH-COOH
½ ½
ОH NH2
2. Моноаминодикарбоновые 3. Диаминомонокарбоновые
Аспарагиновая кислота 3.5 Лизин
HООC-CH2-CH-COOН CH2-(СH2)3-CH-COOН
½ ½ ½
NH2 NH2 NH2
4. Диаминодикарбоновые
Цистин (из 2-х молекул цистеина)
HOOC-CH- СH2 -S-S-СH2 -CH-COOН
½ ½
NH2 NH2
5. Гомоциклические 6. Гетероциклические
5.7. Фенилаланин 6.8. Триптофан
СН СН
// \ // \
HC C-СН2-СН-СООН C C¾ C-СН2-СН-СООН
½ êê ½ ½ êê êê ½
HC C NH2 HC C CH NH2
\\ / \\ / \ /
СН СН NH
8 из этих аминокислот относятся к незаменимым, так как они не синтезируются в организме человека, а поступают из вне с пищей. Пищевая ценность белков характеризуется содержанием в них незаменимых аминокислот.
В мировой практике принято пищевую ценность белков сравнивать с пищевой ценность казеина молока и яичного альбумина, так как они являются полноценными, содержат все незаменимые аминокислоты в достаточном количестве. Белки, содержащие все незаменимые аминокислоты называются полноценными. В основном это белки животного происхождения.
По усвояемости и пищевой ценности белки характеризуются следующими показателями: белки мяса и рыбы – 90%, пшеницы и ячменя – 60-70%, бобовых культур около 70%.
Чтобы определить аминокислотный состав белков проводят его гидролиз и анализируют состав гидролизата.
IV. Структура белковой молекулы.
Белок - это последовательность аминокислот, связанных друг с другом пептидными связями.
Количество аминокислот в белке может быть различно: от минимум двух до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Все белки как минимум имеют три уровня структуры, некоторые - четыре.
Первичная структура – каркас белковой молекулы представляет собой полипептидную цепь, состоящую из аминокислот, соединенных пептидными связями. В формировании первичной структуры участвуют ковалентные связи.
R1-CH-CO-NH-CH2-CO-NH-CH-CO-NH-CH-COOН
½ ½ ½ ½
NH2 R2 R3 R4
От её строения (аминокислотной последовательности) зависят физико-химические свойства белка.
Вторичная структура представляет собой a-спираль, которая возникает в пределах одной полипептидной цепи, или b-складчатую структуру, образующуюся между смежными плипептидными цепями.
 2015-10-16
2015-10-16 392
392







