У поверхневих водах суходолу завжди містяться розчинені гази, які надходять у воду за її контакту з атмосферним повітрям і внаслідок перебігу фізико-хімічних та біологічних процесів. Найважливішими серед них з еколого- токсикологічного погляду є кисень, діоксид вуглецю і сірководень. Інші гази, такі як метан, хлор тощо, потрапляють у природні води за специфічних умов, їх визначають під час спеціальних досліджень.
Кисень
Головними джерелами надходження кисню в поверхневі води суходолу є фотосинтетична діяльність водяних організмів та абсорбція з атмосфери.
Фотосинтетичне продукування кисню відбувається в поверхневому шарі водойми, товщина якого залежить від прозорості води і коливається від кількох десятків сантиметрів до кількох десятків метрів. Кисень з атмосфери адсорбується на поверхні водойми, процес інтенсифікується зі зниженням тем ператури й підвищенням атмосферного тиску. Кисень надходить у водойми також із дощовими водами, які ним пересичені.
Споживання кисню, тобто зменшення його концентрації у природних водах, пов'язано з хімічними й біохімічними процесами окиснення органічних та деяких неорганічних речовин (Fе2+, Мn2+, NH4+, NO2-, Н2S, СН4, Н2 тощо). Швидкість споживання кисню зростає з підвищенням температури, збільшенням кількості бактерій та інших водяних організмів, які піддаються хімічному й біологічному окисненню.
Розчинений кисень у поверхневих водах міститься у вигляді молекул 02. Залежність розчинності кисню від температури в дистильованій воді за нормального тиску наведено в табл. 2.1. Розчинність кисню за нормального тиску називають нормальною концентрацією. Насичення води киснем, яке відповідає нормальній концентрації, взято за 100%. Концентрацію розчиненого кисню виражають у мг 02/дм3 або у відсотках насичення, яке обчислюють за рівнянням
O2% = 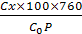 (2.1)
(2.1)
де Сх — концентрація кисню, визначена експериментально, мг 02/дм3; Со — нормальна концентрація за певної температури, яку визначають за даними табл. 2.1, мг 02/дм3; Р — атмосферний тиск у момент проведення аналізу, мм рт.ст.
Таблиця 2.1. Залежність нормальної концентрації кисню (Со) у воді
від температури (за атмосферного тиску 760 мм рт. ст.)
|
У поверхневих водах суходолу концентрація розчиненого кисню може змінюватись від 0 до 14 мг О2/дм3 залежно від інтенсивності двох протилежно спрямованих процесів — надходження і споживання — і як правило не перевищує 100%-го насичення. Однак за інтенсивного фотосинтезу, зокрема під час «цвітіння» води, у поверхневому шарі насиченість води киснем може перевищувати 100 %.
У незабруднених водах концентрація розчиненого кисню влітку вища, ніж взимку, а в поверхневих шарах вища, ніж у придонних. Глибинна стратифікація залежить і від інтенсивності перемішування водних мас. Вона спостерігається у великих річках, озерах, водоймах, ставках — особливо в штильову погоду. Оскільки основним постачальником кисню в поверхневі води є фотосинтез водяними рослинами» то найбільше насичення води киснем спостерігається близько 14 - 15, особливо в сонячну погоду, а найменше — близько 4 - 6-ї години.
Розчинність кисню у воді залежить не тільки від її температури, а й мінералізації води:
| Температура, °С | ||||
| Зменшення розчинності, мг 02/дм3 на кожні 1000 мг солей | 0,08405 | 0,06217 | 0,04777 | 0,04885 |
Коливання вмісту кисню у воді упродовж доби може досягати 2 – 4 мг 02/дм3. Тому для характеристики кисневого режиму певного водного об'єкта потрібно проводити серійний аналіз, відбирати проби води з різних глибин, у різних точках акваторії та в різні години доби.
Для визначення вмісту кисню в природних водах запропоновано багато методів, які ґрунтуються на різних принципах. Для систематичного контролю вмісту кисню в поверхневих водах суходолу рекомендовано титриметричний йодометричний (за Вінклером) та електрохімічний методи.
Йодометричне визначення
Йодометричне визначення кисню проводять у два етапи: фіксують розчинений кисень відразу на місці відбирання проби води і титрують пробу; титрування можна виконувати через деякий час після фіксування, але не пізніше ніж через 1 добу. Метод використовують для аналізу незабарвлених або слабко забарвлених вод із вмістом кисню не менш як 0,05 мг 02/дм3.
Принцип методу. Метод ґрунтується на взаємодії розчиненого у воді кисню з гідроксидом мангану в лужному середовищі:
2Мn(ОН)2↓ + 02 = 2МnО(ОН)2↓.
При цьому розчинений кисень фіксується. Далі, під час розчинення осаду МnО(ОН)2 в кислоті (рН < 1) за надлишку йодиду калію, виділяється йод, кількість якого еквівалентна вмісту розчиненого кисню:
МnО(ОН)2↓ + 2КІ + 2Н2S04 = МnSО4 +І2 + К2S04 + 3H20.
Йод, що виділився, титрують розчином тіосульфату натрію за наявності крохмалю як індикатору:
І2 + 2Nа2S203 = 2NаІ + Nа2S406.
За об'ємом витраченого на титрування розчину тіосульфату натрію обчислюють вміст кисню у воді.
Визначенню кисню цим методом заважають великі кількості суспендованих часточок (зависей). Їх видаляють добавлянням до 1 дм3 проби води перед фіксуванням кисню 10 см3 10%-го розчину алюмокалієвого галуну і 2 см3 концентрованого розчину аміаку. Після відстоювання пробу за допомогою сифона переносять у кисневу склянку. Якщо проба містить органічні зависі, що погано осідають, то її прояснюють. Для цього відразу після відбирання до 1дм3 проби води добавляють 10 см3 суміші розчинів сульфамінової кислоти і хлориду ртуті (32 г сульфамінової кислоти розчиняють у 450 см3 бідистильо- ваної води; 54 г хлориду ртуті розчиняють при нагріванні у 450 см3 бідисти- льованої води; обидва розчини змішують і доводять об'єм бідистильованою водою до 1 дм3).
Якщо у пробі води вміст нітритного азоту перевищує 0,05 мг N/дм3, то перед розчиненням осаду МnО(ОН)2 у кислоті в склянку вносять кілька крапель 5%-го розчину азиду натрію або 40%-го розчину сульфамінової кислоти чи сечовини.
Якщо вміст заліза(ІІІ) понад 1 мг Fе/дм3, то до проби перед розчиненням гідроксидів у кислоті добавляють 1 см3 40%-го розчину фториду калію. Після підкислення проби швидко відтитровують йод, який виділився.
 2015-10-16
2015-10-16 431
431








