1.2.1. Модель промежуточного состояния.
Предложена в 1972 г О.Б. Птицыным. В соответствии с этой моделью фолдинг белка осуществляется в несколько стадий.
1.Случайный клубок – нет ни вторичной ни третичной структур, пептидная цепь развернута.
2. Состояние-предшественник расплавленной глобулы – вторичная структура сформирована не до конца, третичная структура отсутствует, цепь частично развернута.
3.Расплавленная глобула – вторичная структура полностью сформирована, цепь свернута в компактную глобулу, но жесткая третичная структура отсутствует.
4.Нативный белок – цепь свернута в компактную глобулу, которая имеет определенную третичную структуру.
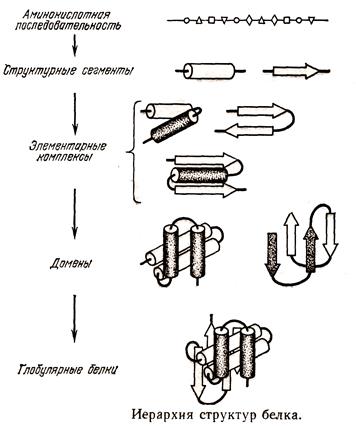 Исходной формой глобулярного белка непосредст-венно после трансляции явля-ется случайный клубокили развернутая цепь. Развернутая не означает растянутая. Если исключить все взаимодействия между аминокислотными остатками в пептидной цепи кроме пептидных связей, то термодинамически наиболее выгодным состоянием цепи будет рыхлый клубок. Чтобы растянуть этот клубок и выпрямить необходимо прило-жить силу. После прекращения действия силы цепь вновь возвращается в наиболее вероятное состояние клубка. Т.е. такой белок подобно каучуку обладает эластично-стью его можно назвать каучукоподобны.
Исходной формой глобулярного белка непосредст-венно после трансляции явля-ется случайный клубокили развернутая цепь. Развернутая не означает растянутая. Если исключить все взаимодействия между аминокислотными остатками в пептидной цепи кроме пептидных связей, то термодинамически наиболее выгодным состоянием цепи будет рыхлый клубок. Чтобы растянуть этот клубок и выпрямить необходимо прило-жить силу. После прекращения действия силы цепь вновь возвращается в наиболее вероятное состояние клубка. Т.е. такой белок подобно каучуку обладает эластично-стью его можно назвать каучукоподобны.
Затем формируется вторичная структура и на следующем этапе - коллапсирование (сжимание) белка в т.н. расплавленную глобулу. Движущей силой сжатия является взаимодействия между радикалами аминокислот. Принципиальное отличие расплавленной глобулы от нативной структуры в том, что в этой глобуле аминокислотные радикалы еще не нашли своих окончательных партнеров не заняли «правильного» положения, а взаимодействуют «с кем придется». Поэтому общее количество одновременно существующих связей относительно невелико и связи, а с ними и конфигурация молекулы, неустойчивы. В конце концов, белок находит термодинамически наиболее оптимальную структуру, при которой между радикалами образуется максимально возможное количество связей. В случае достаточно большого белка вначале формируется структура доменов, и потом они занимают правильное положение друг относительно друга. Позже всего происходит связывание мономеров в олигомеры (если нативный белок состоит из нескольких субъединиц).
1.2.2. Сворачивание по принципу «все или ничего».
В отличие от вышеизложенного, у очень маленьких белков (до 100 аминокислотных остатков) промежуточные стадии (расплавленная глобула и состояние-предшественник) отсутствуют и фолдинг фактически проходит по принципу «все или ничего».
Действительно, из-за малого числа аминокислотных остатков «неправильные» взаимодействия, лежащие в основе расплавленной глобулы, практически не случаются. Поэтому нет феномена коллапсирования (сжатия) клубка до образования нативной третичной структуры.
В этих случаях фолдинг происходит следующим образом. Развернутая пептидная цепь в течение достаточно длительного времени флуктуирует без образования контактов между аминокислотными остатками — просто потому, что способные к взаимодействию остатки не сближаются друг с другом.
Затем случайно цепь достигает состояния, в котором может образоваться несколько «правильных», или нативных, контактов. Тем самым как бы появляется ядро сворачивания (ядро нуклеации).
После этого фолдинг завершается очень быстро. Наличие нескольких «правильных» связей удерживает цепь в такой конфигурации, в которой легко находят друг друга остальные «правильные» пары.
Хорошо изученным белком с подобным механизмом фолдинга является химотрипсиновый ингибитор 2 (белок СI2), включающий 65 аминокислотных остатков. Во вторичной структуре он имеет одну a-спираль и пять тяжей b -структуры (b1,... b5). Критическим моментом фолдинга этого белка служит образование a-спирали и тяжей b4, b5, а также гидрофобное взаимодействие трех аминокислотных остатков в составе этих элементов — Ала16 (a-спираль), Лей49 (b4) и Иле59 (b5). Это и означает формирование ядра нуклеации.
1.2.3. Феномен кооперативности
В обеих изложенных моделях фолдинга очень важную роль играет феномен кооперативности. Суть его в том, что образование одной или нескольких «правильных» связей резко ускоряет замыкание других нативных связей.
На этом, по существу, построено представление о ядре нуклеации. И таков же, очевидно, механизм каждой стадии фолдинга более крупных белков - например, превращения расплавленной глобулы в нативную структуру.
Продемонстрируем значение данного феномена на следующем примере.
Пусть белок включает п = 100 аминокислотных остатков и нативная конформация включает 50 пар строго определенных взаимодействий остатков.
При этих условиях общее число всевозможных комбинаций попарных взаимодействий равно произведению нечетных чисел до n: в данном случае - 3х5х... х97х99 = 3·1078.
Если представить, что в секунду перебирается 1013 различных комбинаций, то в отсутствие эффекта кооперативности среднее время поиска нативной конформации составляло бы 4,5·1057 лет! Что исключает саму возможность не только фолдинга хотя бы одной молекулы белка, но и образования жизни на Земле.
Теперь фолдинг того же белка рассмотрим с учетом феномена кооперативности.
Пусть его вторичная структура включает 5 a-спиральных участков примерно по 20 аминокислотных остатков. Спирализация каждого такого участка поначалу представляет собой свободный перебор всех возможных 190 пар взаимодействия групп —NН2— и —СО—. Из них «правильных» пар -16.
Даже при относительно небольшой скорости перебора в 106 пар в секунду требуются ничтожные доли секунды (порядка 10-5с), чтобы образовалась хотя бы одна «правильная» связь.
Дальше действует эффект кооперативности: от этой связи в обе стороны рассматриваемого участка пептидной цепи с большой скоростью (109 пар/с) начинают замыкаться остальные «правильные» связи a-спирали. Продолжительность этой стадии еще на несколько порядков меньше (около 10-8 с.) чем первой — лимитирующей — стадии.
В итоге спирализация всего участка укладывается практически в те же доли секунды (порядка 10 -5 с), что занимал поиск одной «правильной» связи.
Причем, поскольку все 5 участков спирализуются независимо друг от друга, то за то же время происходит формирование всей вторичной структуры белка.
На этапе образования третичной структуры взаимодействуют радикалы аминокислот, находящихся в разных элементах вторичной структуры (в нашем случае — в разных a-спиралях); взаимодействия же в пределах одного элемента невозможны. Данное обстоятельство само по себе уменьшает количество взаимодействий. Но еще выше роль эффекта кооперативности.
Можно найти, что общее число межрадикальных пар (исключая пары в пределах одной a-спирали) равно 4000. Пусть замыкание из них двух определенных связей имеет критическое значение (подобно образованию ядра нуклеации в случае маленьких белков). При той же скорости перебора, что при образовании вторичной структуры (106 пар/с), на поиск этих связей уходит порядка 10 -3 с.
Остальные связи, благодаря кооперативности, замыкаются гораздо быстрее.
В итоге весь фолдинг белка вместо бесконечного количества лет занимает время меньше секунды. В крайнем случае, для крупных белков со сложной структурой, он укладывается в несколько минут.
1.2.4. Отношение фолдинга к трансляции
Когда происходит фолдинг новых белков — еще в ходе трансляции, лишь по ее окончании, или он столь протяженен, что охватывает и трансляцию, и последующее время?
Известный биохимик А. С. Спирин отстаивает представление о ко-трансляционном сворачивании белков. Согласно ему, фолдинг полипептидной цепи происходит по мере ее роста на рибосоме в направлении от N- к С-концу.
В качестве доказательства приводятся три экспериментальных факта.
а) Фермент ПДИ катализирующий перемещение в новосинтезируемых белках дисульфидных связей, для правильного замыкания этих связей должен присутствовать во время трансляции.
Если его добавить в белоксинтезирующую смесь, составленную in vitro, позже, у белка оказывается неправильная структура и он лишен активности. Это продемонстрировано на примере одной из цепей иммуноглобулина.
б) При синтезе белковых субъединиц гемоглобина они приобретают способность связывать гем еще до окончания трансляции — по достижении примерно двух третей своей полной длины.
Следовательно, гем-связывающий центр формируется во время трансляции.
в) Фермент светлячков люцифераза после денатурации восстанавливает свою активность весьма долго. В то же время он оказывается активным сразу после образования на рибосоме. Значит, и в этом случае фолдинг произошел во время трансляции.
Пока трудно сказать, не допускают ли эти результаты какой-либо другой интерпретации, а если нет, то насколько они являются общими.
Более вероятно, что для одних белков фолдинг, действительно, является только ко-трансляционным, а для других — и ко-, и пост-трансляционным процессом.
 2015-10-16
2015-10-16 4704
4704
