К настоящему времени выявлены и изучены два фермента фолдинга -
протеиндисульфидизомераза (ПДИ) и пептидилпролилизомераза (ППЛ).
1.3.1.1.Протеиндисульфидизомераза (ПДИ)
ПДИ катализирует перемещение в белках дисульфидных связей. Под его влиянием в сворачиваемом белке разрываются одни и вместо них замыкаются другие дисульфидные связи. Например известно, что белок РНКаза состоит из 124 аминокислотных остатков. Из них 8 остатков цистеина, что допускает 105 различных комбинаций замыкания между ними 4-х дисульфидных связей (по законах комбинаторики, количество возможных комбинаций равно произведению нечетных чисел от 1 до n, т.е. 3х5х7=105). Из этих комбинаций только одна является правильной. Без ПДИ замыкание первых попавшихся 4-х дисульфидных связей навсегда зафиксировало бы пептидную цепь в соответствующей конформации, даже если последняя далека от нативной и энергетически невыгодна. Дисульфидные связи являются ковалентными и для их разрыва требуется преодолеть высокий кинетический барьер. Таким образом, лабилизация дисульфидных связей в формирующимся белке дает возможность найти (путем случайного перебора) такую комбинацию этих связей, которой соответствует энергетически наиболее оптимальная пространственная структура.
В клетке ПДИ связана в основном с эндоплазматической сетью. Поэтому особенно велика ее роль в формировании тех белков, которые синтезируются мембраносвязанными рибосомами. Это экспортные, мембранные и лизосомные белки.
1.3.1.2. Пептидилпролилизомераза (ППЛ). Известно, что пролин и продукт его гидроксилирования – гидроксипролин не является аминокислотой т.к. его радикал связан не только с углеродным атомом, но и с азотным. Поэтому образуется не амино-, а иминокислота (рис.1.7). Это сказывается на пространственной конфигурации пептидной цепи в месте содержания пролина. Здесь не образуется ни a-спирали, ни b-структуры, и пептидная цепь часто делает изгиб в ту или иную сторону. Причем возможность изгиба определяется тем, как расположены радикал соседней аминокислоты и радикал пролина относительно плоскости соответствующей пептидной связи (вращения вокруг которой невозможны). Радикалы находятся в транс-конфигурации, если расположены по разные стороны плоскости, и в цис–конфигурации, если находятся с одной стороны.
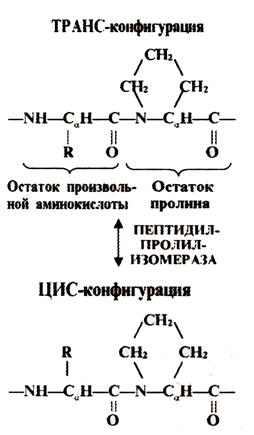 В отсутствии резкого изгиба пептидной цепи предпочтительней транс-конфигурация, т.к. при ней соседние радикалы не «мешают» друг другу.
В отсутствии резкого изгиба пептидной цепи предпочтительней транс-конфигурация, т.к. при ней соседние радикалы не «мешают» друг другу.
В случае изгиба по принципу «поворот на себя» (т.е. почти на 1800) часто более оптимальной является цис-конфигурация, когда оба соседних радикала оказываются с наружной стороны изгиба.
ППИ катализирует переход радикалов в области пептидной связи пролина из транс-конфигурации в цис-конфигурацию и обратно. При этом происходит временный разрыв данной пептидной связи, разрешая поворот вокруг ее плоскости, после поворота связь снова замыкается. Таким образом, ППИ позволяет пептидной цепи в области пролина делать такие изгибы, которые приводят к оптимальной пространственной структуре.
Рис 1.7. Реакция пептидил-
пролилизомеразы
 2015-10-16
2015-10-16 3133
3133








