ОБЩИЕ ПРЕДСТАВЛЕНИЯ О ФОЛДИНГЕ
Процесс образования белков состоит из трех стадий:
· трансляция
· фолдинг
· модификация
и завершается доставкой белка к месту его будущего функционирования. Для этого существуют специальные механизмы, и решение проблемы начинается еще с трансляции.
Трансляция – последовательное включение аминокислот в строящиеся пептидные цепи в соответствии с последовательность кодонов мРНК
В процессе трансляции участвуют 4 вида рРНК, которые в ядрышке объединяются с рибосомальными белками, формируя субъединицы рибосом. Эти субъединицы через ядерные поры перемещаются в цитоплазму. Туда же перемещаются и многие мРНК в комплексе со специальными белками и несколько десятков видов тРНК. С другой стороны в цитоплазме присутствуют 20 видов аминокислот, синтезированных в самой клетке или поступивших из крови. Также здесь находится 20 видов ферментов - аминоацил-тРНК –синтетаза и дополнительные белковые факторы. Все эти вещества участвуют в:
· фолдинге – сворачивание пептидной цепи в пространственную структуру
· модификации – присоединение углеводных компонентов, окисление определенных аминокислотных остатков и т.д.
По месту окончательной локализации в клетке белки подразделяют на: экспортные, мембранные, лизосомальные и внутренние.
Экспортные – т.е. предназначенные к выделению из клетки, мембранные и лизосомальные белки образуются мембраносвязанными рибосомами. Т.е. рибосомами, прикрепленными к поверхности мембран эндоплазматической сети (ЭПС). Благодаря этому конец синтезируемого пептида проникает во внутреннее пространство ЭПС где потом оказывается и весь белок. В этом же пространстве происходит фолдинг и модификация белка. Далее в транспорте и модификации принимают участие другие мембранные структуры, прежде всего аппарат Гольджи и, в конечном счете, белок
- либо выделяется в ходе экзоцитоза из клетки,
- либо включается в состав той или иной мембраны,
- либо остается внутри сформировавшейся лизосомы.
В отличие от этого внутренние белки ( белки гиалоплазмы, митохондрий, ядра и т.д.) синтезируются на свободных, т.е. мембранонесвязанных рибосомах.
СТРОЕНИЕ БЕЛКОВ
Различают несколько уровней структуры белков: первичную, вторичную, третичную, а для олигомерных белков – и четвертичную структуры.
Первичная структура – это последовательность аминокислотных остатков, связанных друг с другом пептидными связями. Именно данная структура непосредственно кодируется последовательностью кодонов в мРНК и воспроизводится при трансляции.
Принципиально важно, что практически все 20 аминокислотных остатков, встречающихся в природных белках, имеют сходный план строения. Они содержат трехчленный остов, со средним (a-углеродным) атомом которого связан тот или иной радикал (R). Соединяясь друг с другом пептидными связями, они формируют непрерывный остов пептидной цепи, где чередуются три типа связи (рис.1.1).
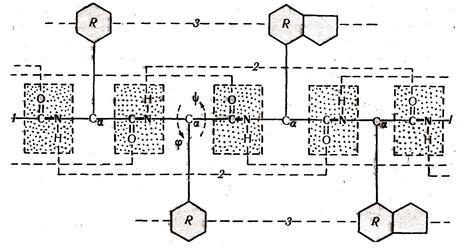
Рис. 1.1 Первичная структура белков
Вокруг одной из них – пептидной связи –СО-NH- вращения невозможны. Вокруг двух остальных –NH-CaН- и –CaН-СО- – возможно вращение. Это позволяет пептидной цепи изгибаться, образовывая вторичную и третичную структуры.
Вторичная структура. Вначале многие фрагменты пептидной цепи приобретают периодическую укладку того или иного типа: a-спираль или b-структура. Такой тип укладки называется вторичной структурой. В одной и той же молекуле глобулярного белка могут встречаться разные виды вторичной структуры и также бесструктурные участки. Соотношение между ними различно (табл.1.1).
В фибриллярных белках вторичная структура как правило однообразна. Альфа спиралью представлены белки – миозин, тропомиозин, альфа-кератин. В этих белках несколько цепей с альфа-спиралью закручены в суперспираль. Белки только с бета-структурой – фибрин шелка и бета-кератин (образуется из a-кератина при обработке горячим паром).
Таблица 1.1. Распределение аминокислотных остатков между тремя
вариантами вторичной структуры
| Белок | Альфа-спираль | Бета-структура | Бесструктурные участки |
| Тубулин | 22% | 30% | 48% |
| Инсулин | 52% | 6% | 42% |
| Миоглобин | 75% | 0% | 25% |
Особый вид вторичной структуры в белке коллагене, который имеет общие черты и с альфа- и с бета- структурами и называется коллагеновой спиралью.
В a-спирали остов пептидной цепи закручивается в спираль так, что радикалы аминокислот обращены наружу от спирали (рис.1.2).
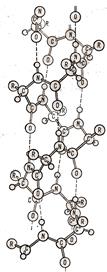
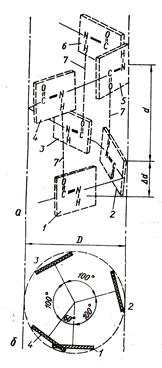
Рис. 1.2. Вторичная структура белков. Альфа-спираль
Структура удерживается водородными связями между остовами аминокислот, причем в образовании такой связи участвует –NH-группа одной аминокислоты и –CO- – другой, которая в пептидной цепи отделена от первой 3-мя другими аминокислотами. В итоге на один виток a-спирали приходится в среднем 3,6 аминокислотных остатков. Альфа-спираль образуется только потому, что является наиболее термодинамически выгодным состоянием для данного участка пептидной цепи.
b-структура – остовы пептидных цепей не скручены в спираль, а имеют зигзагообразную конфигурацию (структура складчатого листа, рис.1.3). Удерживается водородными связями между теми же группами, но теперь (если речь идет о глобулярном белке) для сближения этих групп и образования связей
Рис. 1.3. Вторичная структура белков. Бета-структура
пептидная цепь образует складки 2-х видов – крупные складки в результате поворота цепи на 1800 и мелкие изгибы цепи в пределах одной складки. Прилежащие друг к другу участки цепи в b-структуре могут быть как параллельными так и антипараллельными (рис.1.4 и 1.5).
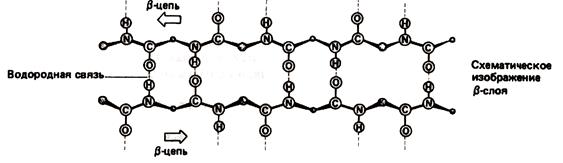
Рис. 1.4. Антипараллельные участи цепи в b-структуре
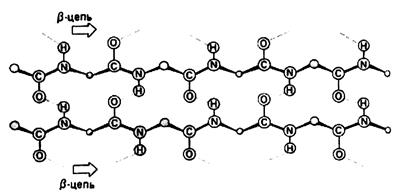
Рис.1. 5. Параллельные участки цепи в b-структуре
В фибриллярных белках с b-спиралью в образовании водородных связей участвуют соседние и расположенные параллельно пептидные цепи.
Вторичная структура белка или его фрагмента определяется его первичной структурой.
Боковые радикалы аминокислот хотя и не участвуют в стабилизирующих эту структуру связях, но определяют, каким образом пептидная цепь может свернуться для образования таких связей и может ли свернуться вообще. Например, остатки пролина и гидроксипролина полностью исключают образование в своем локусе как a-спирали так и b-структуры. Одноименно заряженные радикалы аминокислот из-за взаимного отталкивания не могут сблизиться в a-спирали и т.д.
Третичная структура. О третичной структуре обычно говорят применительно лишь к глобулярным белкам. Под ней понимают конформацию белковой глобулы, т.е. укладка в пространстве a-спиральных, b-структурных и бесструктурных участков пептидной цепи. В отличии от вторичной, третичная структура образуется и удерживается за счет образования связей непосредственно между радикалами аминокислот. Характер связей зависит от природы радикалов (табл.1.2).
Таблица 1.2 Типы радикалов аминокислот и образуемые ими связи
| Типы радикалов | Соответствующие аминокислоты | Примерное содержание в белках | Связи, образуемые радикалами |
| Неполярные радикалы | глицин, аланин, ва-лин, лейцин, изо-лейцин, метионин, фенилаланин, трип-тофан, пролин | 50% | Гидрофобные и Ван-дер-ваальсовые (ин-дукционные и дис-персионные) взаи-модействия |
| Полярные радикалы, не способные к ионизации | серин, треонин, цис-теин, тирозин, гид-роксипролин, аспа-рагин, глутамин | 20% | Водородные связи, а также дисульфид-ные для цистеина |
| Полярные радикалы, способные к ионизации при физиологическом рН | аспарагиновая кис-лота, глутаминовая кислота, аргинин, лизин, гидроксили-зин, гистидин | 30% | Ионные и водо-родные связи |
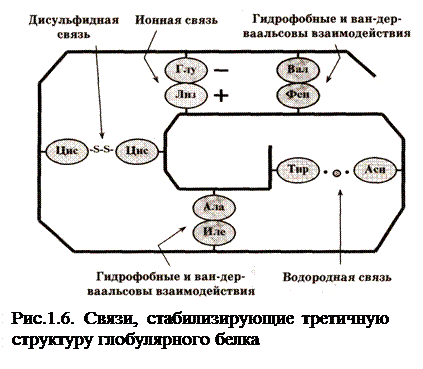
По физико-химическим свойствам радикалы всех аминокислот подразделяют на 3 группы с образованием связей 4-5 видов (рис.1.6):
- ковалентной – дисульфидная связь между остатками цистеина;
- нековалентные (слабые) взаимодействия;
- ионные связи между разноименно заряженными (а следовательно гидрофильными) радикалами;
- водородные связи между полярными (как заряженными, так и незаряженными) радикалами;
- гидрофобные и Ван-дер-ваальсовы взаимодействия между неполярными (т.е. гидрофобными) радикалами.
Слабый характер ионных и водородных связей в значительной мере обусловлен влиянием водной среды, в которой обычно находится белок. Так, дипольные молекулы воды, ориентируясь вокруг полярных (в т. ч. заряженных) радикалов, в 80 раз снижают электрическое поле заряженных радикалов и могут сами образовывать водородные связи с полярными радикалами. На разрушение этих связей расходуется большая часть энергии межрадикального взаимодействия.
Тем не менее замыкание большого числа межрадикальных связей приводит к образованию термодинамически наиболее устойчивой конфигурации — нативной третичной структуры белка.
При этом взаимодействующие друг с другом радикалы могут находиться в вытянутой пептидной цепи весьма далеко друг от друга. Их сближение происходит лишь в результате сложных изгибов полипептидной цепи в трехмерном пространстве.
В итоге образуется глобулярная частица, причем одни радикалы находятся внутри нее, а другие — на ее поверхности. Например, для модельного миоглобиноподобного белка распределение радикалов оказалось следующим (табл. 1.3).
Таблица 1.3. Распределение радикалов в миоглобиноподобном белке
| 60 внутренних радикалов (40%) | 90 наружных радикалов (60%) |
| В том числе: 48 гидрофобных и 12 гидрофильных | В том числе: 28 гидрофобных и 65 гидрофильных |
Как видно из данных табл. 1.3, основная часть гидрофобных радикалов находится внутри глобулы (куда они уходят от водной фазы), а большинство гидрофильных радикалов — на ее поверхности. В то же время это правило не является абсолютным: некоторое количество гидрофобных радикалов остается на поверхности.
Последнее очень важно для взаимодействия белка с лигандами, имеющими гидрофобные группы.
Формирование третичной структуры играет решающую роль в приобретении белком присущей ему функциональной активности. Как правило, именно на уровне этой структуры в белке появляются т.н. активные центры (один или несколько) — группы из нескольких радикалов, способные специфично взаимодействовать с определенными лигандами.
Эти радикалы на уровне первичной структуры зачастую находятся далеко друг от друга и сближаются лишь в процессе фолдинга.
Вместе с тем третичная структура обладает определенной подвижностью. На конформации глобулы могут сказываться следующие факторы:
- тепловые флуктуации и колебания отдельных групп, когда связи между ними то разрываются, то вновь замыкаются;
- специальные вещества-регуляторы;
- химическая модификация белка (например, фосфорилирование);
- само выполнение белком его функции.
Изменение конформации белков — важнейший способ изменения их биологической активности, который широко используется в клетке для регуляции различных процессов.
Четвертичная структура. Понятие четвертичной структуры применимо только к белкам, состоящим из нескольких субъединиц. (напр. гемоглобин состоит из 4 субъединиц 2-х видов). Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуноглобулин, инсулин. Почти все ДНК- и РНК- полимеразы имеют четвертичную структуру. Связи, образующие и поддерживающие четвертичную структуру, те же самые, что и при образовании третичной структуры, кроме гидрофобных.
Субъединицы связываются за счет взаимодействия аминокислотных радикалов расположенных на контактирующих поверхностях субъединиц. Эти поверхности по расположению радикалов являются взаимно комплементарными. В частности, они нередко обогащены гидрофобными и разноименно заряженными радикалами. Таким образом, связывание субъединиц может происходить лишь после образования третичной структуры. И такое связывание само сказывается на третичной структуре доводя ее до функционально активного или неактивного белка. Поэтому такие белки обычно активны лишь в олигомерной форме (гемоглобин) или наоборот только в диссоциированном состоянии (протеинкиназы). В этом случае одни субъединицы служит для подавления активности других и диссоциируют под влиянием специального сигнала (цАМФ).
 2015-10-16
2015-10-16 3138
3138
