Две задачи и один вопрос по теме «Строение атома и химическая связь»
Задача 1. На основе метода ВС предположить пространственное строение молекулы и определить является ли молекула диполем:
1. SnCl2
2. HgCl2
3. CdF2
4. PH3
5. BF3
6. PCl3
7. SiH4
8. CCl4
9. CH3F
10. CH2F2
11. AlCl3
12. ZnCl2
13. NF3
14. GaF3
15. H2Te
16. PbCl2
17. BCl3
18. PF3
19. SiF4
20. AlF3
21. CdCl2
22. GeCl4
23. AsH3
24. BCl3
Электроотрицательность элементов
| Элемент | Al | B | C | Cd | Cl | F | Ga | H |
| c | 1.5 | 2.0 | 2.5 | 1.7 | 3.0 | 4.0 | 1.6 | 2.1 |
| Элемент | Hg | N | P | Pb | Si | Sn | Zn | О |
| c | 1.9 | 3.0 | 2.1 | 1.9 | 1.8 | 1.8 | 1.6 | 3.5 |
Пример.
CO2 (атомы кислорода равноценны и связаны с углеродом двойной связью). cО = 3.5 cС=2.5
1. Электронные конфигурации внешних уровней атомов, образующих молекулу.
С …2s22p2 O …2s22p4
| 2s | 2px | 2py | 2pz | 2s | 2px | 2py | 2pz | |
| | | | | ¯ | ||||
| ¯ | ¯ |
2. Определить электроны, за счет которых будет образовываться химическая связь.
С – все четыре электрона (2s22p2 Þ 2s2p3) О – по два р-электрона
3. Определить необходимость гибридизации и ее тип.
Поскольку С имеет две двойные связи, одна из них должна быть p- связью (рy- и pz-электроны), и атомы О равноценны, то оставшиеся s- и px- электроны гибридизуются (sp-гибридизация).
4. Определить пространственную ориентацию гибридных орбиталей
sp-гибридные орбитали имеют линейную симметрию (угол связи 180°).
5. Определить пространственное расположение атомов и характер связей.
Молекула CO2 линейна. Атом С по оси x связан с каждым О одной s-связью (перекрывание sp-гибридных орбиталей С и px-орбиталей О), а рy- и pz-орбитали перекрываются с р-орбиталями атомов кислорода по p-типу
6. Поляризация связи.
cО = 3.5 cС=2.5 - связи поляризованы на С избыточный +d-заряд, на О -d-заряд.
7. Вследствие линейного строения молекулы CO2 центры тяжести +d и -d совпадают, она не является диполем.
Задача 2. Используя принципы метода МО, составить энергетическую диаграмму молекулы, написать электронную конфигурацию и определить кратность связи:
1. He2
2. He2+
3. Ве2
4. С2
5. N2
6. O2
7. F2
8. Ne2
9. BN
10. CN
11. CN+
12. NO
13. NO+
14. CO
15. Li2
16. Ne2+
17. CO+
18. BN+
19. CO-
20. O2+
21. В2
22. CN-
23. O2-
24. Ве2+
Пример.
Молекула Cl2
1. Электронные конфигурации внешних уровней атомов, образующих молекулу. Сl…3s23p5
2. Определение электронов, образующих молекулярные орбитали(МО). Составление энергетической диаграммы – вариант (а).
 * Молекулы атомов второго периода с Z£ 7 за счет взаимодействия s- и px–орбиталей имеют другой энергетический порядок расположение МО – вариант (б):
* Молекулы атомов второго периода с Z£ 7 за счет взаимодействия s- и px–орбиталей имеют другой энергетический порядок расположение МО – вариант (б):
А) б)
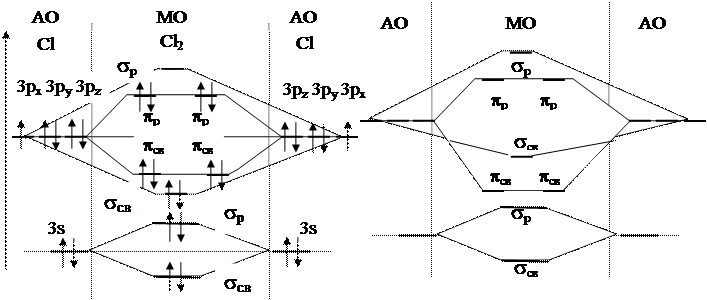
3. Заполнение молекулярных орбиталей электронами.
Суммарное число электронов распределяют по МО с учетом принципов заполнения электронных орбиталей
s – электроны 4 шт. (2 + 2) sсв – 2 sр – 2
р – электроны 10 шт. (5 + 5) pсв – 4 sсв – 2 pр – 4
4. Электронная конфигурация молекулы.
sсв2sр2pсв4sсв2pр4
5. Кратность связи: 8 электронов на связывающих орбиталях, 6 – на разрыхляющих КС = (8 - 6)/2 = 1
6. Молекула диамагнитна (нет неспаренных электронов)
 2015-10-16
2015-10-16 5292
5292







