Равновесная концентрация X* (кг/кг чистого адсорбента) поглощаемого вещества в адсорбенте может быть представлена в виде функции концентрации с и температуры Т:
X* =f (с, Т) (20.1)
или в виде функции парциального давления р и температуры Т в случае адсорбции газов:
X* = f1(p Т), (20.1а)
где с-концентрация адсорбтива в объемной фазе, кг/м3; р - парциальное давление адсорбтива в объемной фазе, Н/м2.
Зависимость X* = φ (с) или X* = ψ(р ) при постоянной температуре называется изотермой адсорбции.
Изотермы адсорбции изображаются кривыми, форма которых определяется в основном природой адсорбата и адсорбента и его пористой Структурой. Из всего многообразия форм изотерм для анализа процессов адсорбции следует выделить выпуклую и вогнутую (рис. 20-1). Важно отметить, что начальные участей изотерм линейны.
Равновесные зависимости описываются рядом эмпирических и теоретических уравнений. Наиболее плодотворной для описания равновесия адсорбционных процессов оказалась теория объемного заполнения пор, явившаяся развитием потенциальной теории адсорбции.
Под адсорбционным потенциалом А понимают работу, совершаемую адсорбционными силами при переносе одного моля адсорбтива из равновесной газовой фазы давлением р на поверхность адсорбционной пленки, Давление над которой принимается равным давлению насыщенного пара адсорбтива ps при рассматриваемой температуре Т.
Адсорбционный потенциал выражается соотношением:
А = RT ln (ps /p). (20.2)
В процессе адсорбции объем микропор VB заполняется адсор-
батом, объем которого может быть вычислен через величину
равновесной адсорбции:
Vn = (X*/M)Vж, (20.3)
где М-молекулярная масса адсорбата; Vж—молярный объем адсорбата.
Установлено, что для разных веществ, адсорбирующихся на одном адсорбенте, отношение адсорбционных потенциалов при одинаковых значениях Vn постоянно и равно коэффициенту аффинности βа, представляющему собой отношение молярных объемов в жидком состоянии, или парахоров, данного и стандартного вещества, значение которого находят в справочнике.
Для ряда микропористых адсорбентов распределение различных заполненных участков адсорбционных объемов имеет вид распределения Гаусса
Vn= V0exp(-A/E)2, (20.4)
где V0- общий объем микропор; Е -параметр функции распределении
При совместном решении уравнений (20.2)-(20.4) с учетом коэффициента аффинности получено уравнение, описывающее изотермы адсорбции для микропористых адсорбентов с однородной пористой структурой:
X* = V0/V ж exp[-B(T/βa)2 ln (ps /p)] (20.5)
где В = (2,303R/E)2 -константа, характеризующая размер пор адсорбента.

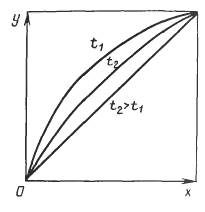
Рис 20-1. Выпуклая и вогнутая изотермы адсорбции
Рис. 20-2. Диаграмма адсорбционного равновесия для бинарной смеси
Наряду с соотношениями, основанными на теории объемного заполнения пор, для описания адсорбционного равновесия используют ряд других уравнений, среди которых наиболее известно уравнение Ленгмюра
X* = Х0кр(1 + кр), (20.6)
где Х0 предельная величина адсорбции (количество компонента, адсорбированного при полном мономолекулв рном покрытии поверхности адсорбента); к - константа, зависящая от температуры.
Для описания равновесных соотношений (особенно при адсорбции газов или паров) используется также уравнение Фрейндлиха
lg Х * = lg к + nig р (20.7)
где к и п величины, приводимые в справочной литературе.
Расчет равновесия адсорбции многокомпонентных смесей особенно важен в процессах разделения смесей (жидких и газовых). Селективность (избирательность) адсорбента оценивается коэффициентом а разделения:
α =y2х1/(х2у1), (20.8)
где x1, x2 и y1, y2—молярные концентрации в твердой и объемной фазе лучше и хуже адсорбирующегося вещества cоответственно.
В случае, когда в смеси присутствуют два адсорбтива, равновесие аналогично бинарным смесям в системе жидкость-пар представляется графически в координатах _у-л\ Если составы фаз выражаются в молярных долях менее сорбирующегося компонента (по аналогии с перегонкой «более летучего»), кривые адсорбционного равновесия располагаются выше диагонали (рис. 20-2), а их кривизна отражается величиной а, определяемой по выражению (20.8). Как видно из рис. 20-2, при увеличении температуры коэффициент разделения а уменьшается. Аналогичное действие на а оказывает увеличение давления.
В случае мономолекулярной адсорбции уравнение Ленгмюра (20.6), действительное для индивидуальных веществ, может быть трансформировано в уравнение, справедливое для адсорбции смесей:
XI* = X0klpI/(1 + ΣklPl). (20.9)
Из уравнения (20.9) для бинарных смесей получим
XI* = X0klpI/(1 + klPl+k2p2) (20.10)
X2* = X0k2p2/(1 + klPl+k2p2) (20.11)
Из уравнений (20.10) и (20.11) при условии постоянства общего давления вытекает соотношение Льюиса, устанавливающее линейную зависимость величин адсорбции компонентов бинарной смеси:
XI*/X01+ X2*/X02 = 1, (20.12)
где Х01, X02 - равновесные концентрации индивидуальных компонентов при давлении, равном сумме их парциальных давлений.
Уравнение Льюиса применяют не только для ленгмюровских, но и для других видов изотерм. С помощью соотношения Льюиса можно построить приближенно кривую адсорбционного равновесия для бинарных смесей на основе изотерм индивидуальных компонентов. Для этого из соотношения (20.12) получим выражение для концентраций XI* и X2*:
XI*= 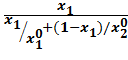
X2*= 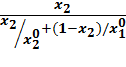
где x1 и y1-молярные доли компонентов в адсорбате.
Изотермы индивидуальных компонентов выражаются следующими функциями:
X*1=f1(p1) X2*= f2(p2)
Если считать f 1-1 и f 2-1 функциями, обратными f 1и f 2, получим выражения в общем виде для кривых адсорбционного равновесия:
y1*= 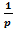 f 1-1[
f 1-1[ 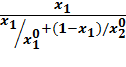 ] (20.15)
] (20.15)
y2*= 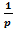 f 2-1[
f 2-1[ 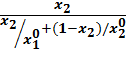 ] (20.16)
] (20.16)
Величины X1 и X2 определяются по изотермам индивидуальных компонентов:
Х01= f1(p1+p2) и Х02= f2(p1+p2)
 2015-10-14
2015-10-14 1928
1928
