5.3.1. Приготовить 4 раствора хлорида железа (III) с различной концентрацией в соответствии с таблицей 5
Таблица 1
| Растворы | Объем раствора, мл | |||
| I | II | III | IV | |
| 0,04М FeCl3 | ||||
| 0,1 М НCl | ||||
| 0,1 М КCl | ||||
| Н2О | ||||
СМ (FeCl3)*)  | 4·10-3 | 8·10-3 | 12·10-3 | 16·10-3 |
*) Примечание: Объем 0,25М раствора иодида калия, добавляемый в каждую пробирку – 20 мл; СМ (КI) = 0,05 моль/л.
5.3.2. При комнатной температуре для раствора с наименьшей концентрацией хлорида железа (III) изучить кинетику реакции по изменению концентрации иода во времени фотоколориметрическим методом до наступления равновесия. Для этого к раствору хлорида железа (III) добавить 20 мл раствора иодида калия и измерить оптическую плотность полученного раствора, отбирая пробы по 1 мл каждые 5 мин. после начала реакции. Измерения проводить на длине волны 490 нм. В качестве раствора сравнения использовать дистиллированную воду. Считать, что равновесие достигнуто, если совпадают результаты двух последовательных измерений.
Концентрацию иода определить по калибровочному графику А = f (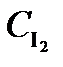 )
)
Результаты измерений свести в таблицу 2.
Таблица 2.
| Время, мин. | Оптическая плотность, А | Концентрация иода, моль/л |
Построить график 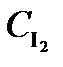 = f (τ).
= f (τ).
5.3.3. Определить равновесную концентрацию иода в растворах с другими концентрациями хлорида железа (III) по истечении интервала времени после начала реакции, определенному в п. 4.3.2. Результаты свести в таблицу 3.
Таблица 3.
| Растворы | I | II | III | IV |
| Оптическая плотность, А | ||||
| Сравн. (I2) |
5.3.4. Составить сокращенно-ионное равнение процесса. Рассчитать равновесные концентрации всех компонентов обратимой системы. Рассчитать константу равновесия.
5.3.5. Возможны варианты при нескольких температурах и одной концентрации компонентов.
5.4. Контрольные вопросы. 
5.4.1. Укажите, какими изменениями концентраций, давления и температуры можно сместить равновесие в сторону продуктов реакции в следующих процессах:
| Fe2O3(к) + 3CO(г) | « | 2 Fe(к) + 3 CO2(г) | DH<0 | |
| С(к) + 2Н2О(г) | « | СО2(г) + 2 Н2(г) | DН>0 | |
| 2 NO(г) + O2(г) | « | 2 NO2(г) | DН<0 | |
| CН4(г) + Н2О(г) | « | СО(г) + 3 Н2(г) | DH<0 | |
| N2(г) + 3 H2(г) | « | 2 NH3(г) | DH<0 | |
| CO2(г) + C(к) | « | 2 CO(г) | DH>0 | |
| Fe2O3(к) + 3 H2(г) | « | 2Fe(к) + 3 H2O(г) | DH>0 | |
| 2 ZnS(к) + 3 O2(г) | « | 2 ZnO(к) + 2 SO2(г) | DH<0 | |
| 2 SO2(г) + O2(г) | « | 2 SO3(г) | DH<0 | |
| CO2(г) + NH3(г) | « | (NH2)2CO(к) + H2O(г) | DH<0 | |
| 2 CO(г) + O2(г) | « | 2 CO2(г) | DH<0 | |
| 2 H2S(г) + O2(г) | « | 2 S(к) + 2 H2O(г) | DH<0 | |
| CH4(г) + 2 H2O(г) | « | CO2(г) + 4 H2(г) | DH>0 | |
| 2 PH3(г) + 4 O2(г) | « | P2O5(к) + 3H2O(ж) | DH<0 | |
| 2Fe(к) + 3 H2O(г) | « | Fe2O3(к) + 3 H2(г) | DH<0 | |
| WO3(к) + 3 H2(г) | « | W(к) + 3 H2O(г) | DH>0 | |
| Cu2O(к) + CO(г) | « | 2 Cu(к) + CO2(г) | DH<0 | |
| SO2(г) + 2 H2(г) | « | S(к) + 2 H2O(г) | DH<0 | |
| H2(г) + I2(г) | « | 2 HI(г) | DH>0 | |
| FeO(к) + CO(г) | « | Fe(к) + CO2(г) | DH<0 | |
| 2 Cl2(г) + 2 H2O(г) | « | 4 HCl(г) + O2(г) | DH>0 | |
| MgO(к) + C(к) | « | Mg(к) + CO(г) | DH>0 | |
| SnCl4(г) + 2 H2S(г) | « | SnS2(к) + 4 HCl(г) | DH>0 | |
| TiO2(к) + 2 C(к) | « | Ti(к) + 2 CO(г) | DH>0 | |
| PbO(к) + CO(г) | « | Pb(к) + CO2(г) | DH<0 | |
| I2(к) + H2S(г) | « | 2 HI(г) + S(к) | DH>0 | |
| 2 NO2(г) | « | N2O4(г) | DH<0 | |
| SnCl4(г) + 2 H2(г) | « | Sn(к) + 4 HCl(г) | DH>0 | |
| Fe3O4(к) +2 C(к) | « | 3Fe(к) + 2 CO2(г) | DH>0 | |
| MgO(к) + 2 HCl(г) | « | MgCl2(к) + H2O(г) | DH<0 | |
| N2(г)+ O2(г) | « | 2NO(г) | DH>0 | |
| CO(г) + H2O(г) | « | CO2(г)+ H2(г) | DH<0 | |
| CaCO3 | « | CaO(к)+ CO2(г) | DH>0 | |
| CH4(г) + CO2(г) | « | 2 CO(г) + 2H2(г) | DH>0 | |
| MnO2 (к) + 4HCl(p-p) | « | MnCl2(p-p)+Cl2(г)+H2O(ж) | DH<0 | |
| 2NO(г))+Cl2(г) | « | 2NOCl(г) | DH<0 | |
| Fe2O3(к) + C(т) | « | 2 FeO(т) + CO(г) | DH>0 | |
| H2O(г) + C(т) | « | CO(г)+ H2(г) | DH>0 | |
| ZnO(т) + CO(г) | « | Zn(т) + CO2(г) | DH>0 | |
| Fe3O4(к) + CO(г) | « | FeO(к) + CO2(г) | DH>0 |
5.4.2. Примерные тестовые вопросы
1. Выберите факторы, не влияющие на скорость реакции:
| a. тепловой эффект реакции | b. масса реакционной смеси |
| c. температура | d. катализатор |
2. Как изменится скорость элементарной реакции 2NO(г) + Cl2(г) ® 2NOCl(г) при уменьшении общего давления в системе в 2 раза?
3. При изучении кинетики реакции A + 2B = D было установлено, что скорость реакции не зависит от концентрации вещества А, а при увеличении концентрации вещества В в 2 раза увеличивается в 4 раза. Каков вид кинетического уравнения этой реакции?
| a. V = k CB2 | b. V = k CA CB2 | c. V = k CA CB | d. V = k CA |
4. В результате каких внешних воздействий равновесие реакции ZnO(к) + CO(г)=Zn(к)+ CO2(г) (DH>0) сместится в сторону исходных веществ:
| a. увеличение парциального давления СО2 | b. уменьшение объема |
| с. увеличение общего давления | d. уменьшение температуры |
5. При изучении кинетики некоторой реакции были получены данные, изображенные на графике. Каков порядок данной реакции?
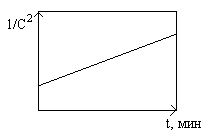
6. Какое внешнее воздействие приведет к уменьшению константы равновесия реакции:
Fe2O3(т) + C(т) = 2FeO(т)+ CO(г); (DH>0)?
| a. увеличение температуры | b. введение катализатора |
| c. увеличение давления | d. уменьшение температуры |
7. При некоторой температуре константа равновесия реакции
Fe3O4(т) + CO(г) = 3FeO(т) + CO2(г)
равна 3. При каком соотношении парциальных давлений СО2 и СО в системе будет идти обратная реакция?
| a. p(CO2) = p(CO) | b. p(CO2)=3p(CO) | c. p(CO2)=2p(CO) | d. p(CO2)=4p(CO) |
8. Рассчитайте DН для процесса: Сграфит®Салмаз по известным энтальпиям сгорания
Сграфит + О2® СО2DН0298 = -393,5 кДж
Салмаз+ О2® СО2DН0298 = -395,4 кДж.
Ответ округлите до целочисленного значения.
9. При увеличении температуры от 20 до 400С скорость реакции возросла в 9 раз. Определите температурный коэффициент скорости реакции.
10. На графике представлено изменение концентраций реагирующих веществ в ходе реакции H2O (г) + C (к) = CO (г) + H2 (г). Рассчитайте константу равновесия.
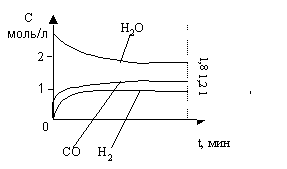
11. Газовая реакция 2NO + O2 = 2NO2 имеет третий общий порядок. Как изменится скорость этой реакции при увеличении общего давления в 3 раза?
12. Какие факторы не влияют на температурный коэффициент скорости реакции?
| а. природа реагирующих веществ | b. тепловой эффект реакции |
| с. энергия активации | d. концентрация реагентов |
13. При 200С некоторая реакция протекает за 45 мин, а при 300С - за 15 мин. Чему равен температурный коэффициент скорости реакции?
14. Для некоторой реакции ΔG0<0. Какие из приведенных утверждений правильны:
| а. константа равновесия реакции больше единицы | b. константа равновесия реакции меньше единицы | |
| с. в равновесной смеси преобладают исходные вещества | d.в равновесной смеси преобладают продукты реакции |
15. В растворе протекает элементарная гомогенная реакция. При разбавлении раствора в 3 раза скорость реакции уменьшается в 9 раз. Каков общий порядок реакции?
16. При 200C константа скорости некоторой реакции равна 10-4 мин-1, а при 500C - 8·10-4 мин-1. Чему равен температурный коэффициент скорости этой реакции?
17. Какое внешнее воздействие приведет к увеличению константы равновесия реакции
ZnO(к)+CO(г)=Zn(к)+CO2(г),(ΔH>0)
| a. увеличение температуры | b. уменьшение температуры |
| c. увеличение давления | d. введение катализатора |
18. Для некоторой реакции константа равновесия уменьшается при увеличении температуры. Каков знак ΔH для этой реакции?
| a. ΔH>0 | b. ΔH<0 | c. ΔH=0 |
19. Выберите фактор, не влияющий на скорость реакции.
| а. температура | b. катализатор |
| с. концентрация веществ | d. тепловой эффект реакции |
20. Энергия активации реакции 1 меньше энергии активации реакции 2. Какая реакция имеет больший температурный коэффициент?
| a. реакция 1 | b. реакция 2 | c. температурные коэффициенты равны |
Лабораторная работа № 6. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. ПОЛУЧЕНИЕ И ИЗУЧЕНИЕ СВОЙСТВ АММИНО-, ГИДРОКСО- И АЦИДОКОМПЛЕКСОВ
 2015-10-14
2015-10-14 944
944








