Мы рассматривали случаи, когда одна из трех величин, характеризующих состояние газа (давление, температура и объем), не изменяется. Мы видели, что если температура постоянна, то давление и объем связаны друг с другом законом Бойля— Мариотта; если объем постоянен, то давление и температура связаны законом Шарля; если постоянно давление, то объем и температура связаны законом Гей-Люссака. Установим связь между давлением, объемом и температурой некоторой
массы газа, если изменяются все три эти величины. Пусть начальные объем, давление и абсолютная температура некоторой массы газа равны V1, P1 и Т1 , конечные — V2, P2 и T2 - Можно представить себе, что переход от начального к конечному состоянию произошел в два этапа. Пусть, например, сначала изменился объем газа от V1 до V2, причем температура Т1 , осталась без
изменения. Получившееся при этом давление газа обозначим Pср. Затем изменилась
температура от Т1 до T2 при постоянном объеме, причем давление изменилось от Pср. до P. Составим таблицу:
|
|
|
Закон Бойля — Мариотта
Р1V1t1
PcpV2T1
Закон Шарля
PcpV2T1
P2V2T2
Применяя, к первому переходу закон Бойля-Мариотта запишем
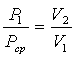 или
или 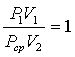
Применяя ко второму переходу закон Шарля, можно написать
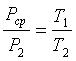
Перемножив эти равенства почленно и сокращая на Pcp получим:
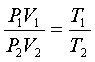 (6)
(6)
Итак, произведение объема некоторой массы, газа на его давление пропорционально абсолютной температуре газа. Это и есть объединенный закон газового состояния или уравнение состояния газа.
 2015-10-13
2015-10-13 770
770








