Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля): Zn | ZnSO4 || CuSO4 | Cu, где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || – солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления, поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Потенциал E электрода рассчитывается по формуле Нернста: 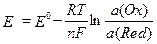 ,
,
где a(Ox) и a(Red) - активности окисленной и восстановленной форм вещества, участвующего в полуреакции; Eo – стандартный потенциал электрода (при a(Ox) = a(Red) =1); n – число электронов, участвующих в полуреакции; R – газовая постоянная; T - абсолютная температура; F - постоянная Фарадея.
При 25o C 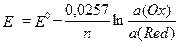 .
.
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов: E = E П - E Л.
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов: E0 = E П0 - E Л0.
Для элемента Даниэля стандартная ЭДС равна
Eo = Eo (Cu2+/Cu) - Eo (Zn2+/Zn) = +0,337 - (-0,763) = +1,100 В.
ЭДС элемента связана с Δ G протекающей в элементе реакции: Δ G = - nFE.
Электролиз
Электрохимическая система, работающая за счет внешнего источника тока, называется электролизером. Количественные соотношения при электролизе устанавливаются на основании (законов Фарадея.
1. Масса вещества, прореагировавшего на электроде при пропускании постоянного электрического тока, пропорциональна силе тока и времени электролиза.
2. Масса различных веществ, выделяемых или растворяемых одним и тем же количеством электричества, пропорциональна их химическим эквивалентам:
тi = МэIt,
где тi – масса вещества, претерпевшего превращение, г; Мэ – молярная масса электрохимического эквивалента вещества, г/Кл или г/(А·ч); I – сила тока, А; t – время электролиза, с.
 2015-10-22
2015-10-22 721
721








