2.1. Круговой процесс (U = const). Очевидно, что в результате такого процесса dU = 0, значит, dQ = dA, или Q = A. В круговом процессе вся работа совершается системой за счет подведения к ней теплоты.
2.2. Изохорный процесс V = const.
Если ΔА’ = 0, pdV =Δ Арасширения = 0. Арасширения = 0.
Qv = dU; Qv =Δ U
В отсутствие полезной работы изменение внутренней энергии равно теплоте изохорного процесса. Это утверждение дает способ экспериментального измерения для изменения внутренней энергии.
2.3. Адиабатический процесс
Q = 0; ΔQ = 0; 0 = dU + Арасшир;
ΔАрасшир = - dU; А = - ΔU.
Работа совершается за счет убыли внутренней энергии, например, за счет охлаждения системы.
2.4. Изобарный процесс p = const
Работа изобарного процесса
ΔА = 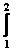 pdV = p (V 2 – V 1) = pΔV
pdV = p (V 2 – V 1) = pΔV
Теплота изобарного процесса
Qp = ΔU + pΔV = (U2 + pV2 ) – (U1 + pV1) = H2 – H1 = ΔH
Qp = ΔH.
Функция, стоящая в скобках называется энтальпией. Таким образом, можно сделать вывод: в отсутствие полезной работы теплота изобарного процесса равна изменению энтальпии
Н  U + pV
U + pV
Энтальпия является функцией состояния системы, и ее изменение не зависит от пути процесса, т.к. изменения всех трех величин U, P и V определяются только начальным и конечным состояниями системы. Абсолютная величина энтальпии, как и внутренней энергии, не может быть определена. На основе экспериментальных данных определяют лишь изменения энтальпии ΔН рассматриваемого вещества при изменении внешних условий или ΔН рассматриваемой системы при протекании в ней процесса.
Первое начало термодинамики имеет важное значение для раздела ФМ, который получил название термохимия.
Термохимия изучает тепловые эффекты, сопровождающие химические и физико-химические процессы, т.е. измерениями теплоты, которая выделяется или поглощается в химических реакциях, фазовых переходах или образовании и разбавлении растворов.
В термохимии обычно используют три понятия стандартных энтальпий различных процессов:
- стандартная энтальпия реакции rH˚ - это энтальпия реакции между веществами, находящимися в стандартных состояниях при температуре Т.
Стандартное состояние – наиболее устойчивая форма чистого вещества, для газов – давление 1 атмосфера и газ должен обладать свойствами идеального газа, т.е. для него справедливо уравнение Менделеева - Клапейрона, конденсированные фазы находятся в равновесии со своим паром. Температура не входит в понятие стандартного состояния. Оно возможно при любой температуре. В справочниках теплоты образования приводятся при температуре 298 К, но это специально оговаривается rH˚298.
Согласно 1-ому закону термодинамики невозможно измерить абсолютное значение энергии, а только ее изменение. Поэтому нужно выбрать для различных веществ условный нуль, относительно которого определяются изменения внутренней энергии. За такой уровень отсчета приняты состояния простых веществ при стандартных условиях. Простые вещества образованы из атомов одного элемента. Если элемент существует в нескольких простых формах, то выбирается наиболее устойчивая модификация H2(газ), O2(газ), N2(газ), Ar(газ), Cграфит, Br2(ж)
-стандартная теплота образования – это тепловой эффект реакции образования вещества из простых веществ в стандартных состояниях. Обозначается ΔfH˚ или ΔfU˚, для простых веществ ΔfH˚=ΔfU˚= 0.
Пример,
Cграф. + 1/2 O2 + 3 H2 = C2 H5 OH(жидк.); ΔrH˚= ΔfH˚
- стандартная энтальпия сгорания ΔсH˚ - изобарный тепловой эффект реакции окисления одного моля вещества газообразным кислородом.
В 1836 г. русский академик, основоположник термохимии Г.И. Гесс на основе проведения большого числа опытов сформулировал закон, который получил его имя, поскольку появился раньше первого закона термодинамики.
Теплота реакции не зависит от пути протекания процесса, т.е. промежуточных химических стадий, через которые он проходит, а только от начального и конечного состояния веществ.
Закон Гесса вкладывает дополнительный смысл в стехиометрическое уравнение реакции, а именно, что каждому веществу соответствует определенный уровень энергии и разность между этими уровнями определяет количество тепла, выделяемое или поглощаемое в химических реакциях. Можно сказать, что вещества образуют потенциальное поле, в котором переходы не зависят от пути процесса.
Э кспериментально теплоты химических реакций определяют в приборе, называемом калориметром. Различают калориметры изотермические, работающие при постоянной температуре, и с переменной температурой, которая и служит измеряемой величиной в этом случае. В последнем случае реакцию проводят в адиабатических условиях. В этом случае изменение ΔU или ΔH происходят за счет химической реакции и за счет изменения температуры.
1-ое следствие из закона Гесса используется для определения теплот химических реакций по справочным данным, т.е. по теплотам образования веществ
 ΔrH˚ =
ΔrH˚ = 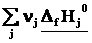
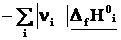 =
= 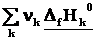
Теплота реакции равна сумме теплот образования конечных веществ минус сумма теплот образования исходных веществ с учетом модуля стехиометрических коэффициентов.
2-ое следствие из закона Гесса – определение теплоты реакции по теплотам сгорания
ΔrН˚ = 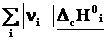 – – 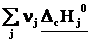 = – = – 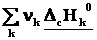
|
 2015-10-22
2015-10-22 221
221








