Е. В. Ванчикова, М. А. Рязанов,
В. В. Сталюгин
ПРАКТИЧЕСКИЕ РАБОТЫ
По физической химии
УДК 54 1.1.076.5
Учебное пособие является руководством к практическим работам по физической химии для студентов высших учебных заведений специальности «химия».
Е. В. Ванчикова, М. А. Рязанов,В. В. Сталюгин, 2008
Институт биологии Коми НЦ УрО РАН, 2008
Сыктывкарский государственный университет, 2008
Содержание
| Числа переноса ионов………………………………………... Работа 1 Определение чисел переноса ионов в растворе серной кислоты ……………………………………………………………………... | |
| Работа 2 Определение чисел переноса ионов в растворе гидроксида натрия...…………………………………………………………………... | |
| Поляризация молекул и молекулярная рефракция………………………………………………………………………. Работа 3 Определение рефракции органических соединений ……...... | |
| Работа 4Определение молекулярной рефракциирастворов и оценка эффективного радиуса молекулы растворенного вещества…………... | |
| Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции ……………………………………………...... | |
| КИНЕТИКА ГОМОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ …...... | |
| Работа 6 Определение порядка реакции окисления йодид-ионов ионами железа (III) …………………………………………………………. | |
| Работа 7 Гидролиз сложного эфира в щелочном растворе ………… | |
| Работа 8 Определение константы скорости и энергии активации реакции гидролиза сложного эфира кондуктометрическим методом | |
| КИНЕТИКА ГОМОГЕННЫХ КАТАЛИТИЧЕСКИХ ХИМИЧЕСКИХ РЕАКЦИЙ …………………………………………………... | |
| Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты …….... | |
| Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара) ………………………………………………………… | |
| Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты ……………………………… | |
| Работа 12 Йодирование ацетона в кислой среде ……………………… | |
| влияния ионной силы на кинетику ионных реакций ………………………………………………………………….. | |
| Работа 13Изучение скорости реакции малахитового зеленого с ионами гидроксила в присутствии солей …………………………………. |
| РАВНОВЕСИЯ В РАСТВОРАХ……………………………………. | |
| Работа 14Определение общего числа поглощающих частиц и константы кислотной диссоциации индикаторов в водных растворах.. | |
| Работа 15 Определение рН образования гидроксида металла и его произведения растворимости …………………………………….. | |
| ЛИТЕРАТУРА…………………………………………………………. | |
| Приложение…………………………………………………………….. Таблица 1 – Коэффициенты распределений (Р = 0.95) | |
| Таблица 2 – Физические свойства воды | |
| Таблица 3 – Свойства органических соединений |
Числа переноса ионов
Электролиз и числа переноса
При пропускании через раствор электролита постоянного электрического тока на катоде происходит восстановление катионов, а на аноде – окисление анионов. Этот процесс называется электролизом.
На основании закона Фарадея масса вещества или ионов, претерпевших окисление или восстановление, пропорциональна количеству протекшего через раствор электричества и массе электрохимического эквивалента этого участника процесса электролиза:
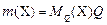 , (1)
, (1)
где 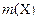 – масса компонента Х, г;
– масса компонента Х, г;
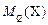 – масса электрохимического эквивалента компонента Х, г/Кл;
– масса электрохимического эквивалента компонента Х, г/Кл;
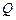 – количество электричества, прошедшего через раствор, Кл.
– количество электричества, прошедшего через раствор, Кл.
Масса электрохимического эквивалента компонента 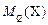 – масса компонента Х, участвующая в процессах электролиза, при прохождении через раствор одного кулона электричества:
– масса компонента Х, участвующая в процессах электролиза, при прохождении через раствор одного кулона электричества:
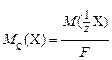 , (2)
, (2)
где 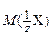 – молярная масса эквивалента компонента Х, г/моль;
– молярная масса эквивалента компонента Х, г/моль;
F = 96500 Кл/моль – число Фарадея – количество электричества, требующееся для превращения 1 моль эквивалентов вещества.
Количество электричества равно:
Q = It, (3)
где I – сила тока, А;
t – время протекания процесса электролиза, с;
Для выражения количества электричества введена единица – кулон:
[ Q ] = [ I ][ t ] = 1 A×c = 1 Кл. (4)
Объединив уравнения 1 ¸ 3, получаем:
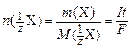 . (5)
. (5)
Уравнение (4) представляет собой аналитическую запись закона Фарадея. 
При электролизе ионы переносят электрические заряды в растворе. Через каждый электрод проходят одинаковые количества электричества, но каждый вид ионов переносит неодинаковую долю электричества, ввиду различия скоростей движения ионов.
Обозначим:
u i – скорость движения иона в электрическом поле, см/с;
ci – молярная концентрация эквивалента i -того иона в растворе, моль/дм3;
l – расстояние между электродами, см;
U – разность потенциалов между электродами, В.
Под воздействием электрического поля через сечение S см2 за время t c пройдет количество эквивалентов i -того иона:
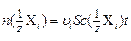 10-3 , моль. (6)
10-3 , моль. (6)
Согласно закону Фарадея, количество электричества, перенесенное i -тым ионом, будет равно:
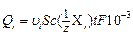 , Кл. (7)
, Кл. (7)
Скорость движения иона в растворе пропорциональна напряженности электрического поля:
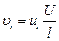 , см/с. (8)
, см/с. (8)
Коэффициент пропорциональности ui называется подвижностью i -того иона. Единицы выражения ui – см2×В-1×с-1.
Следовательно, количество электричества, переносимое катионами и анионами через сечение электролизера (S,см3) за время (t, c), можно выразить уравнениями:
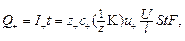 (9)
(9)
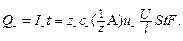 (10)
(10)
Причем, вследствие электронейтральности раствора:
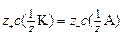 . (11)
. (11)
Числом переноса катиона или аниона называют долю количества электричества, переносимую катионами или анионами соответственно:
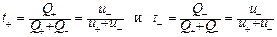 . (12).
. (12).
Таким образом, число переноса иона можно выразить отношением подвижности иона к сумме подвижностей всех ионов, находящихся в растворе.
Произведение подвижности на число Фарадея называется эквивалентной электрической проводимостью иона:
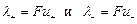 , См×см2×моль-1 (См – сименс). (13)
, См×см2×моль-1 (См – сименс). (13)
Отношение эквивалентной электрической проводимости иона к таковой для электролита также равно числу переноса:
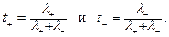 (14)
(14)
Сумма чисел переноса катиона и аниона равна единице:
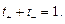 (15)
(15)
При электролизе вследствие перемещений ионов под влиянием электрического поля и превращений их на электродах происходит изменение концентрации электролита в растворе вблизи обоих электродов. Определив это изменение, можно найти числа переноса катионов и анионов, составляющих данный электролит.
Рассмотрим процесс электролиза соединения K m A p в водном растворе с нерастворимыми, например, платиновыми или графитовыми электродами.
Вариант1
Возьмем частный случай, когда в растворе находится один электролит и его же ионы переносят электричество и восстанавливаются на катоде (катионы) и окисляются на аноде (анионы).
Разделим мысленно объем раствора электролита в электролизере на два пространства: катодное и анодное. До электролиза молярная концентрация эквивалента электролита в этих пространствах одинакова. После прохождения через электроды Q кулонов электричества, что соответствует по закону Фарадея разложению количества эквивалентов катионов и анионов участвующего в процессах электролиза электролита:
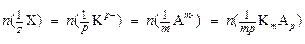 , моль. (16)
, моль. (16)
Процессы, протекающие в катодном и анодном пространстве и изменения состава раствора, представлены в таблицах 1 и 2.
Таблица 1 – Процессы, протекающие в катодном и анодном пространстве
| Катодное пространство (К) | Анодное пространство (А) |
Разряжаются: 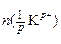 моль катионов; приносится электрическим током моль катионов; приносится электрическим током 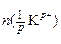 t+ моль катионов; уносится электрическим током t+ моль катионов; уносится электрическим током 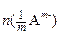 t- анионов. t- анионов. | Разряжаются: 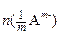 мольанионов; приносится электрическим током мольанионов; приносится электрическим током 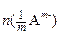 t- моль анионов; уносится электрическим током t- моль анионов; уносится электрическим током 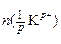 t+ моль катионов. t+ моль катионов. |
Таблица 2 – Изменение состава раствора
| Катодное пространство (К) | Анодное пространство (А) |
Убыль катионов: 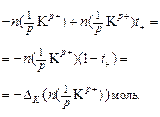 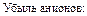 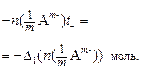 Изменение количества эквивалентов электролита: Изменение количества эквивалентов электролита: 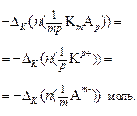 | 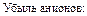  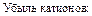 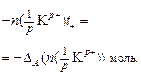 Изменение количества эквивалентов электролита: Изменение количества эквивалентов электролита: 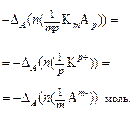 |
Так как количество эквивалентов катионов и количество эквивалентов анионов равно количеству эквивалентов электролита, то можем записать, что изменение количества электролита в катодном пространстве можно оценить по убыли в нем анионов:
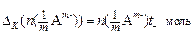 , (17)
, (17)
а изменение количества электролита в анодном пространстве – по убыли катионов:
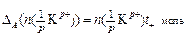 . (18)
. (18)
Следовательно,
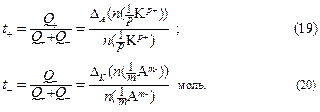
Число переноса катиона равно отношению количества эквивалентов катионов, убывших в анодном пространстве, к количеству эквивалентов катионов, разрядившихся на электроде;
– число переноса аниона равно отношению количества эквивалентов аниона, убывших в катодном пространстве, к количеству эквивалентов анионов, разрядившихся на электроде.
Например, в раствор, содержащий CuCl2, поместили два платиновых электрода, подсоединенных к источнику постоянного тока. Через раствор прошло 96500 Кл электричества, следовательно, в электролизе участвовало 1 моль эквивалентов вещества.
Число переноса ионов меди (II) t + = 0.42, хлорид ионов – t – = 0.58.
Изменение состава системы в катодном пространстве:
– разрядилось на катоде: – n о(1/2Cu2+) = 1 моль;
– принесено электрическим током:
nK (1/2Cu2+) = n о(1/2Cu2+) t + = 0.42 моль;
– убыль количества эквивалентов меди (II): – D K (n (1/2Cu2+))= 0.58 моль;
– унесено электрическим током:
– D K (n (Cl-)) = n о(Cl-) t – = 0.58 моль.
Это равенство используют для расчета числа переноса хлорид-ионов, если известна убыль их в катодном пространстве.
Изменение состава системы в анодном пространстве:
– разрядилось на аноде: – n о(Cl-) = 1 моль;
– принесено электрическим током:
nA (Cl-) = n о(Cl-) t – = 0.58 моль;
– убыль количества эквивалентов хлорид-ионов: – D А (n (Cl-))= 0.42 моль;
– унесено электрическим током:
– D A (n (1/2Cu2+)) = – n о(1/2Cu2+) t + = 0.42 моль.
Это равенство используют для расчета числа переноса ионов меди (II), если известна убыль их в анодном пространстве.
Вариант 2
Для суждения о том, как изменится количество электролита в приэлектродных пространствах, необходимы сведения о протекающих на электродах процессах, зависящих от природы электролитов и материала электродов.
 2015-10-22
2015-10-22 1272
1272







