При электролизе в водном растворе гидроксида натрия с инертными (платиновыми, свинцовыми или графитовыми) электродами электрический ток переносится ионами ОН- и Na+.
На аноде окисляются ионы OH-:
4OH- – 4 e- ® O2 + 2H2O. (24)
Ионы Na+ из анодного пространства перемещаются к катоду, но восстанавливаются на нем ионы H3O+ с выделением водорода:
2H2O + 2 e - ® H2 + 2OH-. (25)
Таким образом, при электролизе в водном растворе гидроксида натрия с инертными электродами так же, как и в растворе серной кислоты, происходит разложение воды и ионов ОН-.
В катодном пространстве количество эквивалентов гидроксида натрия увеличивается, а в анодном – на столько же уменьшается.
Изменение состава раствора гидроксида натрия после электролиза представлено в таблице 4.
Таблица 4 – Изменение состава раствора гидроксида натрия
| Катодное пространство (К) | Анодное пространство (А) |
Прибыль анионов ОН- за счет разложения воды и убыль в анодное пространство переносом электрического тока: 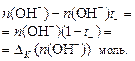 Прибыль катионов Na+: Прибыль катионов Na+: 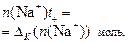 Соблюдается равенство: Соблюдается равенство: 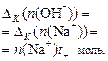 | Убыль анионов ОН- за счет разложения и прибыль из катодного пространства переносом электрического тока: 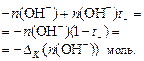 Прибыль анионов SO42-: Прибыль анионов SO42-: 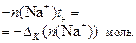 Соблюдается равенство: Соблюдается равенство: 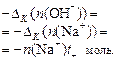 |
Число переноса катиона можно определить, как отношение изменения количества эквивалентов гидроксида натрия в катодном или анодном пространствах к количеству эквивалентов разложившихся ионов на электроде:
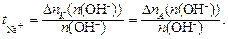 (26)
(26)
Традиционный метод определения чисел переноса по Гитторфу основан на измерении молярной концентрации эквивалента электролита в приэлектродных пространствах до и после электролиза с последующим пересчетом на изменение количества эквивалентов вещества. Общее количество подвергшегося электролизу электролита находят по количеству электричества, прошедшего через исследуемый раствор за время опыта, которое определяют при помощи кулонометра.
 2015-10-22
2015-10-22 4742
4742
