В мерный цилиндр отбирают 20 см3 раствора соли железа (III). Быстро переносят его в колбу 5, раствор перемешивают и засекают время начала реакции (включают секундомер и не выключают его до конца опыта). Оставляют раствор на 2 минуты, в течение которых его не перемешивают. Затем добавляют 2 ÷ 4 капли раствора крахмала и выделившийся йод быстро оттитровывают раствором тиосульфата натрия до исчезновения синей окраски. Отмечают объем добавленного раствора тиосульфата натрия и ждут появления синей окраски раствора. Фиксируют время окрашивания раствора в светло-синий цвет. Оставляют раствор на 2 минуты, в течение которых не перемешивают.
Через 2 минуты добавляют вторую порцию раствора тиосульфата натрия до обесцвечивания системы, вновь фиксируют общий объем добавленного раствора тиосульфата натрия и ждут появления окраски, фиксируют время окрашивания раствора в светло-синий цвет.
Опыт продолжают, пока не добавлено не менее 5 порций раствора тиосульфата натрия.
И в данных системах выполняются равенства (82, 83).
Результаты измерений и расчетов представляют в таблице 6.8.
Таблица 6.8 – Результаты кинетических измерений для раствора 5:
с (Fe3+) = … моль/дм3; с (I-) = … моль/дм3
| Время измерения | Объем титранта | Объем исследуемой смеси | Молярная концентрация ионов железа (II) | 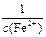 , дм3/моль , дм3/моль | 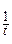 , с-1 , с-1 |
| t, с | V т i, см3 | (V c + Vi -1), см3 | с (Fe2+), моль/дм3 |
Описанные выше процедуры повторяют с растворами в колбах
6 ÷ 8 и заполняют таблицы 6.9 ¸ 6.11, аналогичные таблице 6.8.
 2015-10-22
2015-10-22 802
802








