Реакция йодирования ацетона, катализируемая в водных растворах протонами, протекает по стадиям:
CH3 – CO – CH3 + H+ 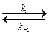 CH3 – C(OH)+ – CH3,
CH3 – C(OH)+ – CH3,
CH3 – C(OH)+ – CH3 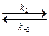 CH3 – C(OH) = CH2 + H+,
CH3 – C(OH) = CH2 + H+,
CH3 – C(OH) = CH2 + I2 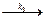 CH3 – CO – CH2I + H+ + I-. (141)
CH3 – CO – CH2I + H+ + I-. (141)
Реакция сопровождается возрастанием концентрации ионов водорода (катализатора), то есть процесс является автокаталитическим.
Методом квазистационарных концентраций или методом маршрутов покажите, при каких условиях скорость расхода ацетона в реакции йодирования не зависит от концентрации йода и может быть выражена уравнением:
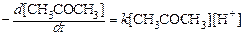 . (142)
. (142)
От констант скоростей каких стадий реакции зависит k?
Обозначим:
а – молярная концентрация ацетона в начальный момент времени, моль/дм3;
b – молярная концентрация эквивалента кислоты в начальный момент времени, моль/дм3;
х – молярная концентрация образовавшегося йодацетона в момент времени t, моль/дм3.
Тогда в момент времени t: 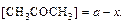
Докажите, что в этот момент времени 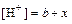 .
.
Уравнение (142) принимает вид:
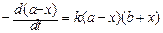 , (143)
, (143)
или
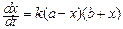 . (144)
. (144)
Интегрирование этого выражения приводит к уравнению:
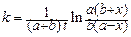 , (145)
, (145)
или линейной функции:
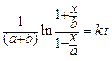 . (146)
. (146)
Выполнение измерений
 2015-10-22
2015-10-22 1832
1832








