| Атом | Полная | Сокращенная | Валентная |
| Водород H | 1s1 | - | 1s1 |
| Азот N | 1s2 2s2 2p3 | 2s2 2p3 | 2s2 2p3 |
| Хлор Cl | 1s2 2s2 2p33s23p5 | 3s23p5 | 3s23p5 |
| Марганец Mn | 1s2 2s2 2p33s23p64s23d5 | 4s23d5 | 4s23d5 |
| Мышьяк As | 1s2 2s2 2p33s23p64s23d104p3 | 4s23d104p3 | 4s24p3 |
| Криптон Kr | 1s2 2s2 2p33s23p64s23d104p6 | 4s23d104p6 | 4s24p6 |
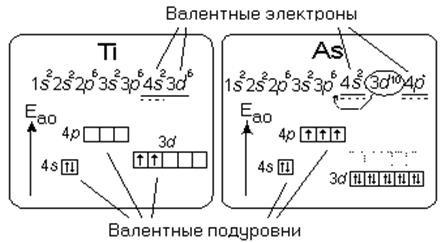
Рис.3.1. Валентные подуровни и валентные электроны атомов титана и мышьяка.
У s- и p- элементов валентными являются электроны внешнего слоя (ns2np6), у d- элементов валентными являются электроны s- состояния внешнего слоя и d – состояния предвнешнего слоя (ns2(n-1)d10), у f- элементов (лантаноиды и актиноиды) электроны f- состояния не являются валентными и в химической связи не участвуют.
Для описания химической связи в веществе необходимо знать распределение электронной плотности атомов. В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую.
Таблица 3.2.
 2015-10-22
2015-10-22 1565
1565








