Пример 1. Выпишите из таблицы D H 0обр (энтальпия образования) следующих веществ: CO2(г), ZnO(к), CaCO3(к), HI(г). Напишите термохимические уравнения, соответствующие данным величинам.
Решение: Стандартная теплота или энтальпия образования D H 0обр - это тепловой эффект реакции образования 1 моля сложного вещества из простых веществ, взятых в наиболее устойчивых состояниях при T =298 K и p =101325 Па.
Таким образом, при написании термохимического уравнения следует учитывать:
1) D H 0обр относится к 1 молю образующегося вещества (продукта реакции); 2) вещество (продукт реакции) образуется из простых веществ, взятых в их наиболее устойчивом состоянии при стандартных условиях, D H 0обр которых условно принимается равным нулю, например:
C(графит) + O2(г) = CO2(г), D H 0обр = -393,77 кДж,
Zn(к) + 0,5 O2(г) = ZnO(к), D H 0обр = -350,66 кДж,
Ca(к) + C(графит) + 1,5O2(г) = CaCO3(к), D H 0обр = - 1207,72 кДж,
0,5 H2(г) + 0,5 I2(к) = HI(г), D H 0обр = 25,94 кДж.
Пример 2. Рассчитать тепловой эффект реакции (D H 0х.р.) 3H2(г) + C2H2(г) = 2CH4(г), пользуясь D H 0обр реагентов. Определить к какому типу (экзотермическая или эндотермическая реакция) она относится.
Решение: выпишем из табл.2 соответствующие значения D H 0обр реагентов (кДж/моль):
| реагент | Н2(г) | С2Н2(г) | СН4(г) |
| D H 0обр, кДж/моль | 226,17 | -74,85 |
По 1 следствию из закона Гесса:
D H 0х..р. = åD H 0обр(пр-тов) - åD H 0обр(исх..в-в)
для данной реакции, с учетом стехиометрических коэффициентов в уравнении перед каждым из реагентов
D H 0х..р. = 2 D H 0обр (СН4) - [3 D H 0обр(Н2) + D H 0обр(С2Н2)} =
= 2(-74,85) – [3´0 + 226,17] = - 376,46 кДж.
Если D H 0х..р.<0, то реакция экзотермическая, т.е. идет с выделением тепла, если D H 0х..р.>0, то реакция эндотермическая т.е. в ходе реакции тепло поглощается.
Т.к. в данной реакции D H 0х..р.<0, следовательно, реакция является экзотермической, т.е. выделяется тепло в количестве эквивалентном изменению энтальпии.
Пример 3. Пользуясь D H 0обр реагентов, рассчитать D H 0х..р. реакции
3CO(г) + Fe2O3(к) = 3 CO2(г) + 2Fe(к).
Сколько тепла выделится, если в результате реакции образуется: а) 1 кг железа; б) 2,24 м3 СО2?
Решение: Пользуясь табл.2, выпишите соответствующие значения D H 0обр реагентов (кДж/моль):
| Реагент | CO(г) | Fe2O3(к) | CO2(г) | Fe(к) |
| D H 0обр,кДж/моль | -110,60 | -822,70 | -393,77 |
Для данной реакции по 1-ому следствию из закона Гесса:
D H 0х..р.=[3D H 0обр(CO2)+2D H 0обр(Fe)] – [3D H 0обр(CO) + D H 0обр(Fe2O3)] = [3(-393,77) + 2´0] – [3(-110,0) + (-822,70) = - 26,81 кДж.
Тепловой эффект реакции относится к строго определенному количеству вещества. Так, в данном случае при выделении 26,81 кДж тепла в реакции участвуют следующие количества 1) молей; 2) граммов реагентов; 3) литров или м3:
| 3CO(г) | + | Fe2O3(к) | = | 3CO2(г) | + | 2Fe(к) | |
| 3 моль | 1 моль | 3 моль | 2 моль | ||||
| 3´28 г | 160 г | 3´44 г | 2´56 г | ||||
| 3´22,4л 3´22,4´10-3м3 | 3´22,4л 3´22,4´10-3м3 |
Для ответа на поставленные в задаче вопросы составляем пропорции:
а) если выделяется 26,81 кДж тепла, образуется 2´56 г Fe
X кДж 1000 г Fe
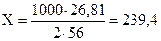 кДж,
кДж,
б) при образовании 3´22,4´10-3м3 выделяется 26,81 кДж тепла
2,24 м3 Х кДж
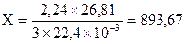 кДж
кДж
Пример 4. При сгорании 3,6 г магния выделилось 90,3 кДж тепла. Определить D H 0обр MgO.
Решение: D H 0обр (MgO) отвечает тепловой эффект реакции образования 1 моль MgO: Mg(к) + 0,5 O2(г) = MgO(к)
3,6 г магния составляют 0,15 моль 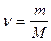
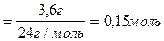
Составляем пропорцию: при сгорании 0,15 моль магния выделяется 90,3 кДж тепла
1 моль Х кДж
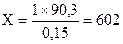 кДж.
кДж.
Т.к. в реакции выделяется тепло, следовательно, D H 0х.р.=-602 кДж.
По 1 следствию из закона Гесса D H 0хр = åD H 0обр(пр-тов) - åD H 0обр(исх..в-в)
Т.е. для данной реакции, с учетом стехиометрических коэффициентов в уравнении:
D H 0х.р. = D H 0обр(MgO)- [ D H 0обр(Mg) +0,5 D H 0обр(O2)]
Из этого уравнения определяем DH0обр MgO
D H 0обр (MgO)=D H 0х.р. +[ D H 0обр(Mg) +0,5 D H 0обр(O2)]=-602 + [0 +0,5´0] =
-602 кДж/моль.
Пример 5. Рассчитать тепловой эффект реакции превращения 1 моль кислорода О2 в озон О3 исходя из следующих термохимических данных:
3As2O3(к) + 3O2(г) = 3As2O5(к), D H 0х.р. = -780,2 кДж
3As2O3(к) + 2O3(г) = 3As2O5(к) , D H 0х.р. = -1065,5 кДж.
Решение: Реакция превращения 1 моль кислорода в озон описывается уравнением
O2 = 2/3 O3. Согласно закона Гесса, вычитая из первого заданного уравнения второе, получаем
3 O2 = 2O3, D H 0х.р. = -780-(-1065,5) = -285,5 кДж.
Для реакции превращения 1-го моля кислорода в озон полученный результат надо разделить на 3:
O2 = 2/3 O3, D H 0 х.р.=285,5/3 = 95,1 кДж.
Пример 6. Пользуясь D H 0сгор., определить какое количество тепла выделится при сгорании 10 л этилена по реакции:
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж).
Реакции горения – это реакции окисления вещества кислородом. В основном, в таких реакциях участвуют теплоносители (Сграфит, Н2, органические соединения). Продукты сгорания органических веществ – это CO2(г) и H2O(ж).
Стандартная энтальпия сгорания D H 0сгор. - это тепловой эффект реакции сгорания 1 моль вещества. Из табл.1, D H 0сгор.(C2H4)= -1410,97 кДж. В нашем случае в реакции участвует 1 моль C2H4, следовательно, в реакции выделяется 1410,97 кДж.
10 л C2H4 содержат 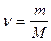
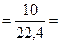 0,45моль
0,45моль
Составляем пропорцию:
при сгорании 1 моль этилена выделяется 1410,97 кДж тепла
0,45 моль Х кДж
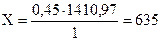 кДж
кДж
Пример 7. На основании табличных значений D G 0обр определить при стандартных условиях возможность самопроизвольного протекания реакций:
а) CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж).
б) 2CH4(г) = C2Н4(г) + 2H2(г).
Решение: Критерием самопроизвольного протекания реакции является изменение энергии Гиббса реакции. В стандартных условиях:
D G 0 х.р. = (å D G 0 обр.)пр-тов - (åD G 0 обр.)исх.в-в
Для реакции а) с учетом коэффициентов в уравнении для каждого вещества
D G 0х..р =[D G 0обр.(СO2)+2D G 0обр(H2O)] - [D G 0обр.(CH4)+2D G 0обр.(O2) = [(-394,6)+ 2(-237,4)] –
-[(-50,85) + 2(0)] = -818,55 кДж; поскольку D G 0 х.р. < 0, то данная реакция в стандартных условиях может протекать самопроизвольно в прямом направлении.
Для реакции б) с учетом коэффициентов в уравнении для каждого вещества
D G 0 х..р =[D G 0обр.(C2Н4)+2D G 0обр(H2)] - 2D G 0обр.(CH4)= [52,28 + 2(0)] -2(-74,86) = 202 кДж.
Поскольку D G 0х.р. > 0, то данная реакция в стандартных условиях может протекать самопроизвольно в обратном направлении.
Пример 8.
Для реакции CH3ОН(ж) = CO2(г) + 2H2(г) определите знак изменения энтропии.
Энтропия (S 0298) – это термодинамическая функция состояния, является мерой неупорядочности системы. Энтропия увеличивается: 1) с ростом температуры; 2) при переходе от твердого состояния к жидкому и от жидкого к газообразному состоянию; 3) в процессах расширения, например, газа; 4) в процессах растворения; 5) в химических реакциях, протекающих с увеличением объема. Наоборот, все процессы, связанные с
увеличением упорядочности (охлаждение, отвердевание, конденсация, сжатие, кристаллизация из растворов, химическая реакция, протекающая с уменьшением объема) сопровождаются уменьшением энтропии. Увеличение или уменьшения объема связано с количеством моль газа. Если в результате реакции увеличивается число моль газообразных веществ, т.е. увеличивается объем, следовательно, и энтропия возрастает (D S 0х.р.>0), если происходит уменьшение числа моль газа, то D S 0х.р.<0.
В данной реакции в исходных веществах газы отсутствуют, а в продуктах образуется (1 + 2)=3 моль газа, т.е. D n газа=3-0= 3 моль. D n газа>0, следовательно, D S 0х..р.>0. Т.о. в ходе реакции идет увеличение энтропии системы.
Задачи
1. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(NH3). Сколько тепла выделится, если в результате реакции образуется 2 моль NH3?
2. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(H2O). Cколько тепла выделится при образовании 1 кг H2O(ж)?
3. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(CH3OH). Сколько тепла выделится, если прореагирует 1 г водорода?
4. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(Cr2O3). Сколько хрома окислилось, если в результате реакции выделилось 11,4 кДж тепла?
5. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(CH3COOH). Сколько грамм и м3 (н.у.) кислорода пошло на окисление, если выделилось 87,38 кДж тепла?
6. Напишите термохимическое уравнение, соответствующее табличному значению D H 0сгор.(С6H6). Сколько тепла выделится, если в реакции участвуют 8 г кислорода?
7. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(CuSO4). Сколько тепла выделится, если образуется 16 г сульфата меди?
8. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(SO3.) Сколько тепла выделится, если расходуется 6,4 г серы?
9. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(FeO). Сколько тепла выделится, если образуется 144 г оксида железа?
10. Напишите термохимическое уравнение, соответствующее табличному значению D H 0обр(KOH). Сколько тепла выделится, если образуется 2,8 г едкого кали?
11. На основании табличных данных D H 0обр реагентов рассчитать тепловой эффект реакции 2 C(графит) + H2(г) =C2H2(г). Определить к какому типу (экзо- или эндотермическая) она относится.
12. Пользуясь D H 0обр реагентов, рассчитать тепловой эффект реакции
3 C2H4(г) = 2CH4(г) + 2 C2H2(г).
13. Найти D H 0х.р , пользуясь табличными значениями D H 0обр для реакции
C2H5OH(ж) = C2H4(г) + H2O(ж).
14. Пользуясь табличными значениями D H 0сгор., определить тепловой эффект реакции
6 С(графит) +3 H2(г) = C6H6(ж).
Экзо- или эндотермическая это реакция?
15. Рассчитать тепловой эффект реакции C(графит) + 2H2(г) = CH4(г) на основании табличных значений D H 0сгор. реагентов. С выделением или поглощением тепла протекает данная реакция?
16. Рассчитать количество выделенного тепла, если в процессе алюмотермии, описываемом уравнением 2 Al(к) + Fe2O3(к) = Al2O3(к) + 2Fe(к), прореагировало 2,7 кг алюминия. Необходимые данные взять из таблицы 1.
17. В основе работы медноокисного гальванического элемента лежит суммарная реакция Zn(к) + CuO(к) = ZnO(к) + Cu(к). Сколько тепла выделится или поглотится, если в реакции
участвуют 32,5г цинка?
18. Определить D H 0х.р для реакции 2 HCl(г) + Ca(к) = CaCl2(к) + H2(г), пользуясь D H 0обр реагентов. Сколько молей HCl вступило в реакцию, если выделилось 171,75 кДж тепла?
19. Уравнение суммарной реакции, протекающей при получении железа в доменной печи:
Fe2O3(к) + 1,5 C(кокс) = 1,5 CO2(г) + 2 Fe(к). Найти тепловой эффект реакции, пользуясь табличными значениями D H 0обр. Сколько тепла затрачивается на получение 10 кг железа?
20. Пользуясь табличными значениями D H 0обр реагентов, найти тепловой эффект реакции 2 Al(к) + Cr2O3(к) =Al2O3(к) + 2Cr(к). Сколько тепла выделилось при образовании 1 г хрома?
21. Сколько тепла поглотится по реакции ZnO(к) + C(графит) = Zn(к) + CO(г), если образуется 1 т цинка?
22. Моноксид углерода СО используют для получения железа из руды по реакции:
Fe2O3(к) + 3 CO(г) = 2 Fe(к) + 3 CO2(г), DH0х.р. = -27,43 кДж. Сколько м3 СО необходимо для получения 1 кг железа, какое количество теплоты при этом выделится?
23. D H 0сгор. метана СН4 составляет – 890,31 кДж/моль. Почему метан представляет собой лучшее топливо, чем водяной газ (СО + Н2)? Горение водяного газа описывается уравнением CO(г) + H2(г) + O2(г) = CO2(г) + H2O(ж)? Ответ дать на основании расчета.
24. Пользуясь табличными данными D H 0обр, рассчитать тепловой эффект реакции получения водяного газа С(графит) + H2O(ж) = CO(г)+ H2(г). Экзо- или эндотермическая это реакция?
25. Вычислить D H 0сгор этилена (С2Н4) на основании энтальпии образования реагентов, учитывая, что продуктами реакции являются CO2(г) и H2O(ж). Какое количество тепла выделится при горении 1 л этилена?
26. Какое количество теплоты выделится при сгорании 1л H2S по реакции
2H2S(г) + 3 O2(г) = 2H2O(ж) + 2 SO2(г)?
27. Найти D H 0сгор алмаза, если D H 0сгор графита = -393,5 кДж/моль, а энтальпия фазового перехода С(графит) → С(алмаз) DH0фп =-1,88 кДж/моль.
28. На основании термохимического расчета D H 0х..р. определите экзо- или эндотермической является реакция 3 SiO2(к) + 4 Al(к) = 2 Al2O3(к) + 3 Si(к).
29. Какое количество теплоты, потребуется на разложение 10 кг карбоната натрия по реакции Na2CO3 (к) = Na2O(к) + CO2(г)?
30. Вычислить энтальпию образования HCl(г), если при взаимодействии 1,12 л водорода с хлором выделяется 9,24 кДж тепла.
31. Вычислить энтальпию образования CO2(г), если известно, что при полном сгорании 1 г углерода выделяется 32,8 кДж тепла.
32. Вычислить энтальпию образования FeO, если при взаимодействии 5,6 г железа с кислородом выделяется 26,5 кДж тепла.
33. Какое количество теплоты выделится при переходе 1 кг красного фосфора в черный по реакции P(красный) → P(черный)?
D H 0обр(Ркрасный) = -18,41 кДж/моль, D H 0обр(Рчерный) = -43,2 кДж/моль?
34. При образовании 1 г CCl4 из простых веществ выделяется 0,67 кДж теплоты. Вычислите (D H 0обр.) ССl4.
35. При окисления 10,8 г серебра выделилось 1,58 кДж тепла. Найти D H 0обр ( Ag2O).
36. Пользуясь табличными значениями D H 0обр найти D H 0х.р дляреакции
3Fe(к) + 4 H2O(г) = Fe3O4(к) + 4 H2(г). Определите к какому типу (экзо- или эндотермическая реакция) она относится.
37. На окисление некоторого количества алюминия пошло 10 л (н.у.) кислорода. При этом выделилось 490 кДж тепла. Определить D H 0обр ( Al2O3).
38. При окислении 10 г кальция выделилось 158,8 кДж тепла. Определить D H 0обр ( СаО).
39. Вычислить D H 0 перехода Н2О(ж)® Н2О(г), на основании
следующих термохимических уравнений:
Н2(г) + 0,5 О2(г) = Н2О(г) D H 0х.р = -241,8 кДж,
Н2О(ж) = Н2(г) + 0,5 О2(г) D H 0х.р = 286,02 кДж.
40. На основании табличных значений D G 0обр реагентов определить возможность самопроизвольного протекания реакции при стандартных условиях. Укажите знак D S 0х.р. Ответ обоснуйте.
а) С(графит) + СО2(г) = 2СО(г),
б) СаСО3(к) = СаО(к) + СО2(г),
в) 2NO(г) + O2(г) = 2NO2(г),
г) CO(г)+ H2O(г) = CO2(г) + H2(г),
д) PCl3(г) + Cl2(г) = PCl5(г),
е) 3 Fe(к) + 4 H2O(г) = Fe3O4(к) + 4 H2(г),
ж) CH4(г) + I2(г) = CH3I(ж) + HI(г),
з) 2 CO(г) + 2 H2(г) = CH4(г) + CO2(г),
и) 2 SO2(г) + O2(г) = 2 SO3(г),
к) 4 HCl(г) + O2(г) = 2 H2O(г) + 2Cl2(г),
л) MgCO3(к) = MgO(к) + CO2(г),
м) NH3(г) + HCl(г) = NH4Cl(к),
н) SiO2(к) + 2 C(графит) + 2Cl2(г) = SiCl4(ж) + 2CO(г),
о) FeO(к) + CO(г) = Fe(к) + CO2(г),
п) NH4NO3(к) = N2O(г) + 2 H2O(г),
р) MnO2(к) + 2C(графит) = Mn(к) + 2 CO(г),
с) Fe2O3(к) + 3 H2(г)= 2 Fe(к) + 3 H2O(г),
т) CuS(к) + 2 O2(г)= CuSO4(к),
у) 2 PbS(к) + 3 O2(г) = 2 PbO(к) + 2 SO2(г),
ф) SiCl4(ж) + 3 H2O(ж) = H2SiO3(к) + 4 HCl(г),
х) Al2O3(к) + 3 SO3(г) = Al2(SО4)3(к),
ц) PbO(к) + CO(г) = Pb(к) + CO2(г),
ч)SiO2(к) + 2 C(графит) = Si(к) + 2 CO(г),
ш) COCl2(г) = CO(г) + Cl2(г).
 2015-10-22
2015-10-22 6252
6252








