
Математическое выражение константы равновесия в условия Р, Т =const
 ,
,
где Р - равновесные парциальные давления реагентов, указанных в нижнем индексе.
Для реакции аА + bB +…= dD + qQ+… связь Кр и Кс устанавливается с использованием закона Клайперона-Менделеева: Кр = Кс (RT)D n, где D n - разность сумм стехиометрических коэффициентов продуктов реакции и исходных веществ, находящихся в газообразном состоянии, т.е. D n =(d + q +…) – (a + b +…).
В нашем случае D n =2 – (1+3) =-2 и, следовательно, Кр = Кс (RT)-2, т.е. Кр и Кс численно не совпадают.
Пример 2. Реакция протекает по уравнению H2(г) + I2(г) = 2HI(г). Определить исходные концентрации водорода и иода, если равновесные концентрации (моль/л): [H2] = 1; [I2]= 2; [HI] = 10. Установить взаимосвязь Кр и Кс.
Решение: Исходная концентрация каждого вещества равна сумме количества прореагировавшего вещества и его равновесной концентрации:
С исх = С равн + С прореаг.
Количества прореагировавших водорода и иода определяем из уравнения реакции,
согласно которому для образования 2 моль необходимо израсходовать по 1 моль водорода и иода. Следовательно, для образования 10 моль HI к моменту равновесия прореагировало по 5 моль H2 и I2. Т.о.,
С исх (H2) = 5+1 = 6 моль/л;
С исх (I2) = 5+2 = 7моль/л.
Взаимосвязь Кр и Кс устанавливается согласно уравнению Кр = Кс (RT)D n, D n =2 – (1+1) =0 и, следовательно, Кр = Кс (RT)0= Кс.
Пример 3. Рассчитать константу равновесия реакции
С(графит) +СО2(г) = 2СО(г), если исходная концентрация СО2 равна 2,4 моль/л, а к моменту равновесия его прореагировало 60%. В сторону расходования или в сторону образования СО сдвигается равновесие при уменьшении давления?
Решение:
Данная реакция является гетерогенным процессом, и с учетом того, что концентрация твердой фазы С(графит) -это постоянная величина (условно принимается за 1), математическое выражение константы равновесия записывается в виде:

В процессе реакции изменяется концентрация только СО2. По условию задачи к моменту равновесия прореагировало 60% исходного количества углекислого газа:
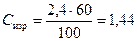 моль/л,
моль/л,
следовательно, равновесная концентрация СО2:
С равн = С исх – С прореаг, т.е.
 = 2,4 – 1,44 = 0,96 моль/л.
= 2,4 – 1,44 = 0,96 моль/л.
Сравнивая стехиометрические коэффициенты реакции, видим, что СО образуется в 2 раза больше, чем расходуется СО2, т.е. 2´1,44 = 2,88моль/л.
 2015-10-22
2015-10-22 1276
1276
