1.Уравнение состояния идеального газа (уравнение Менделеева-
Клапейрона)

где p, V – давление и объём, занимаемый данной массой газа; m,  – масса и молярная масса газа; R – универсальная газовая постоянная;
– масса и молярная масса газа; R – универсальная газовая постоянная;
T – термодинамическая температура  К; t – температура по шкале Цельсия;
К; t – температура по шкале Цельсия;  – количество вещества.
– количество вещества.
2. Для смеси газов справедлив закон Дальтона

где  – парциальное давление
– парциальное давление  компонента смеси; k – число компонентов смеси.
компонента смеси; k – число компонентов смеси.
3.Основное уравнение молекулярно-кинетической теории газов
 или
или 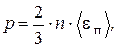
где  – масса одной молекулы; n – концентрация молекул;
– масса одной молекулы; n – концентрация молекул;  – средняя квадратичная скорость молекул;
– средняя квадратичная скорость молекул;  – средняя кинетическая энергия поступательного движения молекул.
– средняя кинетическая энергия поступательного движения молекул.
4. Средняя кинетическая энергия молекулы (с учётом поступательного и вращательного движений)

где i – число степеней свободы (для одноатомной молекулы i= 3 ( пост .); для двухатомной молекулы i= 5 (3 пост. + 2 вращ.); для трех- и более атомной молекулы i= 6 (3 пост.+ 3 пост.)); k – постоянная Больцмана.
5. Скорость молекул:
 средняя квадратичная
средняя квадратичная


 средняя арифметическая
средняя арифметическая

 ,
,
 наиболее вероятная
наиболее вероятная
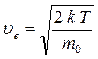 ;
;  .
.
6. Зависимость давления газа от концентрации молекул и температуры

7. Теплоёмкость системы (тела)
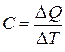 ,
,
где  – количество теплоты, сообщённое системе (телу);
– количество теплоты, сообщённое системе (телу); 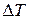 – изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
– изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
8. Молярная и удельная теплоёмкости
 ;
;  .
.
9. Молярные теплоёмкости идеального газа при постоянном объёме  и постоянном давлении
и постоянном давлении 
 ;
;  .
.
10. Соотношение между молярной и удельной теплоёмкостями

11. Удельные теплоёмкости при постоянном объёме  и постоянном давлении С P уд
и постоянном давлении С P уд
СV уд  ; С Р уд
; С Р уд  .
.
12. Отношение теплоёмкостей (показатель адиабаты)

13. Внутренняя энергия идеального газа массой m при температуре Т

14. Первое начало термодинамики

где Q – количество теплоты, сообщённое газу в рассматриваемом процессе; 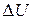 – изменение внутренней энергии в данном процессе;
– изменение внутренней энергии в данном процессе;
А – работа газа над внешними силами.
15. Работа, совершаемая газом, при изменении его объёма

где  ,
,  и
и  – начальный и конечный объём соответственно.
– начальный и конечный объём соответственно.
16. Для любого процесса, происходящего с идеальным газом, изменение внутренней энергии рассчитывается по одной и той же формуле
 .
.
17. Количество теплоты и работа, совершаемая газом, зависит от вида процесса.
• Изотермический процесс: T= const; 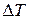 = 0;
= 0;  ;
;
 .
.
• Изохорический процесс: V= const; 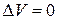 ;
;  ;
;
 .
.
• Изобарический процесс Р = const;
 ,
, 
• Адиабатный процесс – процесс, при котором отсутствует теплообмен между системой и окружающей средой:
Q адиаб = 0,
А адиаб = 
или
 А адиаб =
А адиаб =  ,
,
где γ– показатель адиабаты.
18. КПД тепловой машины:
• любой

• идеальной, работающей по циклу Карно
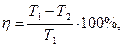
где А – полезная работа;  и
и  – соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;
– соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;  и
и  – соответственно температуры нагревателя и холодильника.
– соответственно температуры нагревателя и холодильника.
19. Средняя длина свободного пробега молекул газа

где d – эффективный диаметр молекулы; n – концентрация молекул в единице объёма.
Пример 1.
В сосуде  л содержится 10 г азота
л содержится 10 г азота 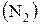 и 20 г углекислого газа
и 20 г углекислого газа  при
при  К. Определить молярную массу смеси и давление смеси до и после её нагревания до температуры 400К.
К. Определить молярную массу смеси и давление смеси до и после её нагревания до температуры 400К.
Дано:  л =
л =  ;
;  г = 0,01 кг;
г = 0,01 кг;  г = 0,02 кг;
г = 0,02 кг;  К.
К.
Найти: р;  ; р/ (T / = 400 K).
; р/ (T / = 400 K).
Решение:
Согласно закону Дальтона
 (1)
(1)
Запишем парциальные давления газа азота 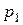 и углекислого газа
и углекислого газа  , используя уравнение состояния:
, используя уравнение состояния:
 , (2)
, (2)
 (3)
(3)
Согласно таблице Менделеева Д.И.
 г/моль = 28∙10 –3 кг/моль
г/моль = 28∙10 –3 кг/моль
 г/моль = 44∙10 –3 кг/моль
г/моль = 44∙10 –3 кг/моль
Подставив (2) и (3) в (1), получим

Выполним вычисления p до нагревания6
 Па.
Па.
Молярная масса смеси
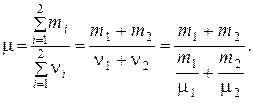
Выполним вычисления  :
:
 кг/моль.
кг/моль.
Так как объём смеси не изменяется, то уравнение состояния газа можно записать в виде

Тогда
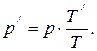
Найдем давление смеси после её нагревания:
 Па.
Па.
Ответ:  Па;
Па;  кг/моль;
кг/моль;  Па.
Па.
Пример 2. Найти КПД тепловой машины работающей по циклу, состоящего из двух изохор и двух изобар, если известно что 

 Дж/(К∙моль).
Дж/(К∙моль).
Дано:  ;
;  ;
;  Дж/(К∙моль).
Дж/(К∙моль).
Найти:  .
.
Решение:
Изобразим цикл, по которому работает тепловая машина в координатах  (рис. 1).
(рис. 1).
 |
Рис. 1
Согласно рис.1 



По определению КПД

Работа тепловой машины за цикл численно равна площади фигуры, ограниченной кривой цикла. В данной задаче работа численно равна площади прямоугольника. Тогда

так как 

Используя уравнение состояния  , выражение для работы газа примет вид:
, выражение для работы газа примет вид:
 (1)
(1)
В процессах 1–2 и 2–3 рабочее тело получает количество теплоты, так как с газом происходит изохорное нагревание и изобарное расширение. Тогда
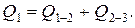
В процессах 3 – 4 и 4 – 1 рабочее тело машины отдаёт количество теплоты, так как с газом происходит изохорное охлаждение и изобарное сжатие.
Распишем  согласно изопроцессам
согласно изопроцессам
 (2)
(2)
Используя уравнение состояния  , определим температуры
, определим температуры  и
и  :
:
1) в процессе 1 – 2 (V 1 = V 2 Þ изохорный процесс)
 или
или  ; (3)
; (3)
2) в процессе 2 – 3 (Р 2 = Р 3 Þ изобарный процесс)

или учитывая, что V 3 = 2× V 2 получим
 (4)
(4)
Молярные теплоёмкости в изобарном и изохорном процессах:
 (5)
(5)
Подставим (3), (4), (5) в (2):
 (6)
(6)
Подставим (6) и (1) в выражение для определения  :
:

Выполним вычисления:
 или
или  .
.
Ответ:  .
.
ЭЛЕКТРОСТАТИКА
 2015-10-22
2015-10-22 632
632








