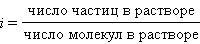Обратный осмос заключается в фильтровании растворов под давлением, превышающем осмотическое, через полупроницаемые мембраны, пропускающие молекулы воды, но задерживающие молекулы или ионы растворенных низкомолекулярных веществ.
Отчего обратный осмос получил такое название?
Если отделить воду от водного раствора полупроницаемой мембраной, то вода будет самопроизвольно переходить в сторону раствора. Это обычный, или, как стали говорить в последние годы, прямой осмос.
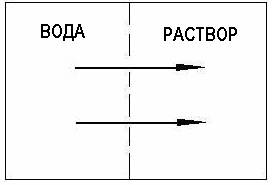
Если приложить к раствору давление, равное осмотическому, то наступает равновесие: сколько воды переходит слева направо, столько же и справа налево.

Если давление, прилагаемое к раствору, больше осмотического, то будет происходить течение воды из раствора в сторону чистой воды, т.е. в направлении, обратном направлению течения воды в прямом осмосе.

Из такой упрощенной схемы следует, что движущей силой обратного осмоса является разница между приложенным гидростатическим давлением и осмотическим давлением раствора. При практическом проведении обратного осмоса мы сталкиваемся с тем, что почти никогда мембраны не обладают идеальной полупроницаемостью, т.е. не полностью задерживают молекулы и ионы растворенных веществ. К тому же, со стороны раствора возникает явление концентрационной поляризации, из-за которой концентрация растворенных веществ у поверхности мембраны больше, чем в объеме раствора. Наконец, давление со стороны воды может быть больше атмосферного из-за гидравлического сопротивления дренажного канала. Поэтому более строгая запись выражения для движущей силы обратного осмоса Δp имеет следующий вид:
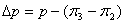 , (1)
, (1)
Здесь p – разность гидростатического давления над раствором и пермеатом, π3 – осмотическое давление разделяемого раствора у поверхности мембраны, π2 – осмотическое давление пермеата, т.е. воды (с некоторой примесью растворенных веществ), перешедшей через мембрану.
Величину p обычно называют рабочим давлением.
Для расчета движущей силы необходимо уметь определять осмотическое давление.
Первое аналитическое выражение для расчета осмотического давления было предложено Вант-Гоффом:
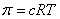 , Па (2)
, Па (2)
Здесь c – концентрация растворенного вещества, кмоль/м3 раствора (численно равная концентрации в размерности моль/литр раствора), R – универсальная газовая постоянная (R = 8314 Дж/кмоль·К), T – абсолютная температура, К.
Вант-Гофф получил это уравнение, исследуя осмотическое давление растворов сахара. Позднее было установлено, что в такой форме уравнение применимо к ограниченному числу недиссоциирующих растворенных веществ.
Электролиты, как известно, в той или иной степени диссоциируют, и для расчета их осмотических давлений в настоящее время используют следующие уравнения.
Для слабых электролитов:
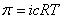 , Па (3)
, Па (3)
где
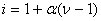 ,
,
α – степень диссоциации растворенного вещества, ν – число ионов, образующихся при диссоциации одной молекулы.
π = νФ cRT, Па (4)
где Ф – практический осмотический коэффициент.
В разбавленных растворах Ф очень близок к единице и осмотическое давление пропорционально концентрации. С увеличением концентрации Ф может меняться произвольным образом (увеличиваться, снижаться, проходить через экстремумы) и быть как больше, так и меньше единицы.
Несмотря на сравнительно высокие рабочие давления, обратный осмос оказывается энергетически выгоднее большинства других массообменных процессов и даже многокорпусного выпаривания.
Работу, необходимую для продавливания воды через мембрану, А, можно представить как произведение рабочего давления на объем прошедшей через мембрану воды V. Вот, какова будет работа на продавливание 1м3 воды при сравнительно высоком рабочем давлении 5 МПа:
 (Дж)
(Дж)
Сравнительно малые затраты энергии в обратном осмосе объясняются тем, что разделение осуществляется без фазовых превращений и почти всегда при температуре окружающей среды. Последнее обстоятельство помимо экономии энергии на подогрев раствора обеспечивает еще одно важное достоинство – возможность разделения нетермостойких растворов.
Следует отметить и простоту конструкции установок обратного осмоса, которые включают только два основных элемента – мембранный аппарат и насос. Простейшая установка обратного осмоса имеет следующий вид:
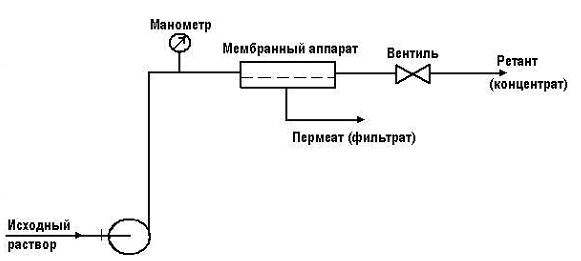
Исходный раствор подается насосом в напорный канал мембранного аппарата, где разделяется на два потока – прошедший через мембрану (пермеат, или фильтрат) и задержанный мембраной (ретант, или концентрат). Необходимое рабочее давление в системе поддерживается с помощью вентиля на линии концентрата и контролируется по манометру.
42. Осмос и осмотическое давление.
Осмос – самопроизвольный переход вещества (обычно растворителя), через полупроницаемую мембрану, отделяющую раствор от чистого растворителя, или от раствора меньшей концентрации.

Суть процесса:
Осмос обусловлен стремлением системы к термодинамическому равновесию и выравниванию концентраций растворов по обе стороны мембраны путем односторонней диффузии молекул растворителя.
Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворенного вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа:
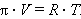 |
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде
|
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C(B) в формуле Вант-Гоффа соотношением (m(B) ∙ 1000 / μ(B) ∙ V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:
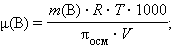 |
m (B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул:
|
!!! Интересно!!!
Осмометр – прибор для измерения осмотического давления или концентрации осмотически активных веществ; применяется при биофизических и биохимических исследованиях.
43. Первопорация: общие сведения о процессе, схемы процесса, транспорт в мембране, характеристики.
Первопорация - процесс переноса вещества через непористые полимерные материалы (мембраны). Непористыми называются селективные мембраны, не имеющие сквозных пор (то есть постоянных во времени полостей между надмолекулярными структурами полимера) для их заполнения потоком проникающего вещества.
Внешняя целостность полимера первапорационной мембраны – воображаемая. В действительности он пронизан большим количеством поверхностей разрыва, которые при отсутствии внешних воздействий в результате тепловых флуктуаций спонтанно образуются, растут, исчезают и перемещаются, схлопываясь в одном месте и возникая в другом. Такие поверхности разрыва образуют совокупность микрополостей («дырок») – межмолекулярных промежутков, не имеющих определенных форм и размеров. В соответствии с теорией Френкеля – Эйринга, процесс диффузии в полимерных мембранах представляет собой перемещение молекул сорбата из одного равновесного состояния в другое.
Процесс переноса вещества в первапорационной мембране можно качественно представить в виде движения молекул в неупорядоченной массе полимерных цепей и «дырок» и рассматривать в виде последовательности: сорбции вещества поверхностью мембраны, рассматриваемой как суммарный процесс, обусловленный несколькими видами взаимодействия, каждый из которых может быть определяющим на различных стадиях сорбции в зависимости от химической природы компонентов и условий эксперимента; диффузии вещества через мембрану, рассматриваемой или как неактивированный процесс, при котором возникновение «дырки» вблизи диффундирующей молекулы не связано с энергетическими затратами, или как активированный, обусловленный случайным увеличением кинетической энергии диффундирующей молекулы; десорбции вещества на противоположной стороне мембраны.
Схема первапорационного разделения жидкой смеси:
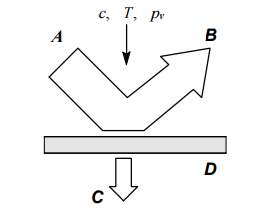
Схема процесса первапорации показана на рисунке. Исходная разделяемая система приводится в контакт с непористой мембраной. Благодаря разделительным свойствам мембраны, различные компоненты системы с различной скоростью будут сорбироваться поверхностью мембраны, диффундировать в ней и десорбироваться на ее противоположной стороне. Вследствие этого поток, который прошел через мембрану, обогащается компонентами разделяемой системы. Можно подобрать мембрану таким образом, что в потоке, выходящем из мембранного аппарата, практически не будет отдельных компонентов смеси.
В сложном процессе - первапорация - происходит тепло- и массоперенос. Мембрана действует как барьер между двумя фазами — жидкостью и паром, причем считается, что фазовый переход происходит на всем протяжении от входа в мембрану до образования пермеата. Это подразумевает, что необходимо подводить тепло, по крайней мере достаточное для испарения. Из-за сосуществования жидкости и пара первапорацию часто относят к своеобразному экстрактивно-дистилляционному процессу, в котором мембрана выполняет роль третьего компонента. В то же время в основе принципа разделения с помощью дистилляции лежит равновесие пар — жидкость, тогда как разделение при первапорации основано на различиях коэффициентов растворимости и диффузии. Равновесие пар — жидкость непосредственно влияет на движущую силу процесса, а вследствие этого и на характеристики разделения.
Типы первапорации:
1) гидрофильная первапорация
2)органофильная первапорация (подразделяется на гидрофобную и органоселективную)
Гидрофильная первапорация
используется для решения таких задач, как дегидратация органических растворителей (например: изопропилового спирта, пиридина, уксусной кислоты) и выделение воды из различных водоорганических, в том числе азеотропных, смесей (например: из смеси с этанолом).
Применяется гидрофобная первапорация для очистки различных сточных вод, удаления легколетучих органических компонентов из грунтовой и питьевой воды, регенерации органических компонентов в пищевой промышленности, разделения продуктов ферментации в биотехнологии.
Органоселективная первапорация
перспективна для разделения смесей органических компонентов.
В соответствии с этими задачами разделения гидрофильная и органоселективная первапорация могут быть альтернативой таким процессам, как дистилляция, ректификация, азеотропная и экстрактивная ректификация, экстракция и адсорбция.
Для поддержания движущей силы процесса первапорации на высоком уровне необходимо обеспечить благоприятные условия для удаления пермеата от поверхности мембраны, обращенной к дренажу и предотвратить конденсацию его паров на этой поверхности. Существует несколько способов поддерживания движущей силы для обеспечения стационарного разделения, при этом обычно процесс первапорации проводят тремя различными способами:
(А) вакуумная первапорация;
(Б) термопервапорация;
(В) первапорация с газом-носителем (в поток газа-носителя)
При вакуумной первапорации движущая сила поддерживается вакуумированием подмембранного пространства. При этом остаточное давление в дренаже должно быть существенно ниже давления насыщенных паров компонентов при температуре разделения, чтобы они оставались в парообразном состоянии. Использование откачивания предполагается только для компенсации возможных натеканий воздуха в систему. Наличие неконедсирующихся газов (например, воздуха) в дренажном канале существенно влияет на характеристики первапорационного разделения. Присутствие воздуха резко снижает интенсивность конденсации паров пермеата, так как при этом скорость конденсации определяется скоростью диффузии паров к поверхности конденсации через слой воздуха, образующийся у этой поверхности. Благодаря простоте реализации и минимальной потребности в оборудовании, в промышленности обычно используется именно вакуумная первапорация.
Схема процесса вакуумной первапорации:

В случае термопервапорации разность парциальных давлений поддерживается созданием градиента температуры через мембрану (при этом температура разделяемой смеси значительно превышает температуру пермеата). В некоторых системах устройства нагрева разделяемой смеси и охлаждения пермеата располагают параллельно мембране, и таким образом происходит непрерывный нагрев разделяемой смеси и конденсация паров пермеата на охлаждаемой поверхности, расположенной на некотором расстоянии от мембраны.
Схема процесса термопервапорации:

При первапорации с газом-носителем перепад парциального давления поддерживается за счет удаления пермеата от поверхности мембраны, обращенной к дренажу при помощи потока инертного газа-носителя. Так как этот газ может быть нагрет, появляется возможность подвода тепла для испарения пермеата. Этот способ реализации первапорации требует наибольшего количества оборудования, и поэтому пока ограниченно используется даже в лабораторных исследованиях.
При промышленной реализации первапорации с газом-носителем возможно организовать замкнутый цикл циркуляции по газу, однако при этом становятся существенными проблемы с выбором достаточно эффективной конструкции конденсатора, в котором должна происходить конденсация паров пермеата в избытке газа-носителя. В качестве носителя, удаляющего пермеат с поверхности мембраны, может также использоваться жидкость, при этом процесс называют осмотической дистилляцией, однако, при его осуществлении велики теплопотери за счет интенсивного теплообмена между разделяемой жидкостью и потоком жидкого носителя, а также возникает необходимость последующего выделения различными способами пермеата из этой жидкости.
Схема процесса первапорации с газом-носителем:
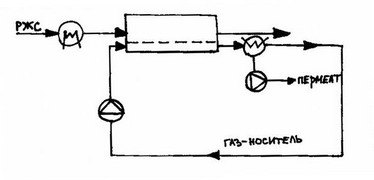
Однако, если селективность мембраны высока, то более выгодна схема без конденсатора (рис. 2.4). При этом поток пермеата сбрасывается в атмосферу. Данная схема пригодна только в случае нетоксичности пермеата.
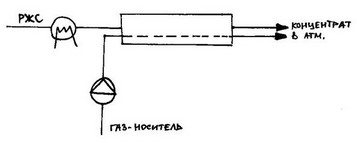
Альтернативой первапорации с газом-носителем является первапорация с паром носителем (в качестве пара-носителя могут выступать вода или же несмешивающиеся с водой жидкости):
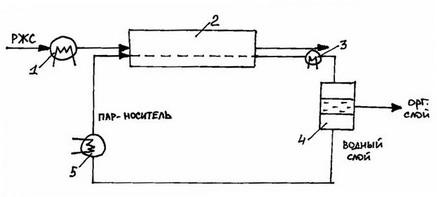
2.5. Схема первапорации с паром-носителем:
1 – подогреватель; 2 – мембранный аппарат; 3 – конденсатор; 4 – сепаратор (отстойник);
5 – подогреватель-кипятильник.
Основные характеристики процесса:
Основными характеристиками первапорации являются:
1) проницаемость
2) селективность
Проницаемостью называется свойство мембраны пропускать вещество. Чтобы оценить этот процесс, вводятся понятия потока и константы проницаемости.
Поток вещества через мембрану – это масса вещества, которая переносится при первапорации за единицу времени через поверхность мембраны единичной площади, ориентированную нормально к направлению потока.
Селективность – это свойство мембраны иметь различную проницаемость для компонентов разделяемой смеси. Количественно селективность оценивается фактором и коэффициентом разделения, которые характеризуют изменение соотношения компонентов смеси в результате первапорации.
44. Газоразделение: общие сведения о процессе, схемы процесса, транспорт в мембране, характеристики.
Мембранное разделение газовых смесей основано на использовании селективно-проницаемых мембран. Наименьшей ячейкой мембранного массообменного устройства является мембранный элемент. Обычно мембрана представляет собой жесткую перегородку, разделяющую мембранный элемент на две рабочие зоны. В этих зонах, напорном и дренажном каналах, поддерживаются различные давления и составы смеси. Из напорного канала через селективно-проницаемую мембрану проникают все компоненты смеси, но с различной скоростью.
Схема процесса газоразделения:

В результате того, что различные компоненты проникают через мембрану с различной скоростью, смесь, поступающая в напорный канал, обогащается труднопроникающими компонентами и удаляется из него. Из дренажного канала отводится смесь, обогащенная компонентами, проникающими через мембрану с большей скоростью. Мембраны для газоразделения могут иметь однородную структуру, но чаще используются асимметричные и композиционные мембраны. Такие мембраны имеют тонкий селективный слой и пористую подложку, причем основное сопротивление массопереносу сосредоточено в селективном слое мембраны.
Обычно предполагают, что плотность потока i-го компонента смеси 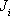 через мембрану линейно зависит от разности парциальных давлений этого компонента над и под мембраной:
через мембрану линейно зависит от разности парциальных давлений этого компонента над и под мембраной:
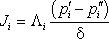
Здесь 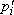 и
и  – парциальные давления компонента вблизи поверхности мембраны в напорном и дренажном каналах соответственно; d – толщина селективного слоя мембраны; Li – коэффициент проницаемости, численно равный плотности потока компонента при значении градиента парциального давления, равном единице. Предполагается, что сопротивлением массопереносу в пористой подложке можно пренебречь.
– парциальные давления компонента вблизи поверхности мембраны в напорном и дренажном каналах соответственно; d – толщина селективного слоя мембраны; Li – коэффициент проницаемости, численно равный плотности потока компонента при значении градиента парциального давления, равном единице. Предполагается, что сопротивлением массопереносу в пористой подложке можно пренебречь.
Разделительную способность мембраны принято характеризовать при помощи фактора разделения мембраны:

Отношение проницаемостей 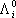 и
и 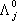 чистых газов
чистых газов 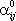 называется идеальным фактором разделения.
называется идеальным фактором разделения.
Все мембраны подразделяются на две группы:
1) с пористой матрицей
2) сплошной матрицей.
Мембранные системы с пористыми мембранами могут быть газодиффузионными и сорбционно-диффузионными, с непористыми мембранами – сорбционно-диффузионными и реакционно-диффузионными.
Системы первого типа характеризуются тем, что взаимодействие молекул газа с мембраной заключается только в соударениях молекул с поверхностью пор. Заметной адсорбции газов на поверхности пор, а тем более капиллярной конденсации не наблюдается. Влияние свойств матрицы мембраны на перенос газов через нее определяется только структурой пор мембраны.
Системы второго типа характеризуются существенным влиянием поверхностных явлений, в первую очередь адсорбции, на перенос газов через мембрану.
Проникновение газов через непористые сорбционно-диффузионные полимерные мембраны представляет собой сложный процесс, который можно разбить на несколько стадий:
1) адсорбцию газа на поверхности мембраны
2) растворение газа в полимере;
3) диффузию газа через мембрану;
4) выделение газа из раствора на противоположной стороне мембраны;
5) десорбцию газа с этой поверхности.
Первую и вторую стадии, а также четвертую и пятую, не всегда можно отчетливо различить. В непористых реакционно-диффузионных мембранах протекают химические реакции между компонентами разделяемой газовой смеси и материалом мембраны. В результате происходит образование новых веществ, участвующих в переносе целевого компонента.
Пористые мембраны существуют как неорганические, так и полимерные. Матрицы пористых мембран, применяемых для мембранного разделения газов, имеют средние радиусы пор в пределах от ~1,5 нм до 200 нм. На процессы переноса компонентов газа в таких мембранах, оказывают влияние структурные характеристики пористой среды. К их числу относится пористость.
Пористость - это объемная доля пор, суммарная поверхность всех пор в единице объема пористого тела, средний диаметр пор. Большое значение имеет также распределение пор по размерам и степень извилистости каналов. Если мембрана имеет крупные поры, то разделение происходит преимущественно за счет различия молекулярных масс разделяемых компонентов. Коэффициент разделения α, определяемый как отношение потоков двух компонентов J1 и J2, является степенной функцией отношения их молекулярных масс М1 и М2

Такой механизм реализуется в случае, если длина свободного пробега молекул газов значительно больше диаметра пор. В мембранах меньшего размера пор действуют также и другие механизмы разделения, в том числе важную роль приобретает взаимодействие компонентов со стенками пор в мембране (ситовый эффект, адсорбция).
Единственным механизмом переноса через непористую мембрану является диффузия растворенного вещества в мембране. Молекулы газа, попадая на поверхность мембраны, сорбируются этой поверхностью и растворяются.
45. Диализ: общие сведения о процессе, схемы процесса, транспорт в мембране, характеристики.
Диализ представляет собой мембранный процесс, с помощью которого различные растворенные вещества, имеющие разные молекулярные массы, могут быть разделены за счет диффузии через полупроницаемую мембрану.
Принципиальная схема процесса диализа:
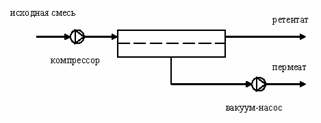
На рисунке представлена схема мембранного модуля, работающего в режиме противотока.
С одной стороны от мембраны движется исходный раствор, из которого удаляются некоторые компоненты. Раствор, в который переносятся некоторые компоненты исходного раствора, называется диализатом. Движущей силой процесса диализа является градиент концентрации. При наличии градиента концентрации растворенное вещество диффундирует из исходного раствора через мембрану в диализат. Разделение растворенных веществ достигается за счет того, что скорости их переноса через мембрану различаются.
Так как процесс диализа протекает под действием градиента концентрации, для получения больших потоков вещества через мембрану необходимо, чтобы толщина мембраны была мала, а разность концентраций переносимого через мембрану компонента по разные стороны от мембраны – наоборот, велика.
При проведении процесса диализа используют непористые мембраны. Для того чтобы скорость диффузии вещества в мембране была достаточно велика, необходимо использовать мембраны, которые могут сильно набухать.
!!!Известно, что в результате набухания мембраны коэффициент диффузии низкомолекулярного вещества в мембране может увеличиться на несколько порядков величины. Селективность разделения достигается в основном за счет различия молекулярных масс компонентов раствора.
Коэффициенты диффузии веществ уменьшаются при увеличении молекулярной массы. Поэтому процесс диализа может использоваться для отделения веществ от коллоидов с малой молекулярной массой.
Поток растворенного вещества через мембрану в процессе диализа описывается при помощи уравнения:
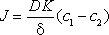 ,
,
(где D – коэффициент диффузии; K – коэффициент распределения, т. е. отношение концентраций вещества в мембране и в жидкости; d – толщина мембраны; c1 и c2 – концентрации вещества по разные стороны от мембраны)
В противоположную сторону будет переноситься растворитель, поток которого будет пропорционален разности осмотических давлений по разные стороны от мембраны.
Диализ используют главным образом для разделения компонентов с различными молекулярными массами. Обычно процесс диализа применяется для водных растворов. В этом случае используют гидрофильные полимерные мембраны. Материалы, из которых изготавливают такие мембраны, представляют собой продукты переработки целлюлозы, поливиниловый спирт, полиакриловую кислоту, поликарбонаты, и т.д.
!!! Просто интересно!!!
Наиболее важным применением процесса диализа является гемодиализ. В этом случае мембраны используются для удаления из крови людей, страдающих почечной недостаточностью, токсических низкомолекулярных веществ: мочевины, креатина, фосфатов и мочевой кислоты.
!!! Неожиданно!!!
Процесс диализа применяется также для удаления спирта из пива.
 2015-10-22
2015-10-22 7945
7945