 (3) и
(3) и  (4).
(4).

Рис. 7.
Для определения значения КР пользуются эмпирическими формулами по типу уравнения Нернста, дающими достаточно точный результат. Например, для определения реакции диссоциации молекулярного водорода может быть использовано такое уравнение:
 .
.
Следовательно, задаваясь определенными значениями температуры при постоянном давлении Р, можно установить величину КР, а затем, пользуясь выражением (4), - степень диссоциации соответствующего газа для этой температуры.
На рис.? приведена зависимость между степенью диссоциации молекулярных водорода и азота и температурной среды. Из рис.? видно, что с увеличением температуры степень диссоциации газов растет, приближаясь к единице.
Если принять, что температура столба дуги составляет в среднем 5000 К, то для такой температуры расчеты дадут значение степени диссоциации молекул водорода  , и молекул азота
, и молекул азота  .
.
Большое значение диссоциации двух атомных газов в зоне сварки объясняется следующими основными причинами:
1) в атомарном состоянии газы приобретают высокую химическую активность и легко взаимодействуют с расплавленным металлом капель и сварочной ванны;
2) параллельно с диссоциацией газов, протекающей в зоне высоких температур с поглощением тепла, вблизи сварочной ванны, где температура значительно ниже, идет обратный процесс образования молекул из атомов, сопровождающийся выделением тепла.
Благодаря двум процессам осуществляется регулирование теплового состояния в зоне сварки – перенос тепла от участка высоких температур к жидкому металлу ванны.
Аналогично протекает диссоциация трех атомных газов(пары воды и СО2 в сварочных процессах).
Водяной пар диссоциирует по уравнению
 ,
,  кДж/моль
кДж/моль
или
 ,
,  кДж/моль.
кДж/моль.
Константа равновесия этой реакции
 .
.
Диссоциация водяных паров может создать для жидкого металла окислительную или восстановительную атмосферу, в зависимости от условий протекания реакций.
Если упругость диссоциации водяного пара превышает упругость диссоциации окисла металла, металл может окисляться за счет кислорода диссоциированного водяного пара:
при 
 .
.
Если же упругость диссоциации водяного пара меньше упругости диссоциации окисла металла, металл будет восстанавливаться из окисла водородом диссоциированного водяного пара:
при 
 .
.
С увеличением температуры степень диссоциации водяных паров увеличивается и приближается к единице при 5000 К.
Углекислый газ при высоких температурах также активно диссоциирует по реакции
 ,
, 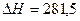 кДж/моль.
кДж/моль.
Константа равновесия этой реакции зависит от температуры и определяется из приближенного уравнения
 ,
,
где  ,
,  ,
,  - парциальные давления соответствующих газов;
- парциальные давления соответствующих газов;
Т – абсолютная температура.
Задаваясь соответствующими температурами, с помощью этого уравнения можно определить отвечающий им состав газов.
На рис. 120 б приведен результат таких расчетов для интервала 1800 – 4000 К. В области Т=4000 К СО2 почти полностью диссоциирован. В близи поверхности сварочной ванны (при Т=1800–2000 К) диссоциация СО2 незначительна.

Рис. 8.
В зависимости от парциального давления кислорода направление реакции (198) может определять окислительный или восстановительный характер среды.
Если  , то будут развиваться окислительные процессы, т.е. если упругость диссоциации окисла металла меньше упругости диссоциации СО2.
, то будут развиваться окислительные процессы, т.е. если упругость диссоциации окисла металла меньше упругости диссоциации СО2.
 .
.
 .
.
При  среда проявляет восстановительные свойства.
среда проявляет восстановительные свойства.
 .
.
 .
.
Парциальное давление кислорода в реакции зависит от температуры, давления и соотношения концентраций СО2 и СО:
 .
.
Это значит, что с увеличением температуры Т и отношения  , а также при уменьшении давления Р в системе, растет окислительная способность среды. Однако присутствие твердого углерода (например, в виде угольного электрода) весьма существенно снижает эту способность, т.к. энергично развивается
, а также при уменьшении давления Р в системе, растет окислительная способность среды. Однако присутствие твердого углерода (например, в виде угольного электрода) весьма существенно снижает эту способность, т.к. энергично развивается
 - 41,1 ккал/моль.
- 41,1 ккал/моль.
На рис. 120 а дана зависимость концентрации СО и СО2 от температуры в присутствии твердого углерода.
Уже при 1400 К в газовой смеси содержание СО приближается к 100%. Следовательно, создается восстановительная среда для металла и становится возможной реакция типа.
 2017-10-25
2017-10-25 588
588








