1. Водород в жидкой стали и сварных швах.

Водород является вредной примесью в металлах. Он ухудшает пластичность сварных соединений и способствует образованию пор, флокенов, трещин в металле шва и зоне термического влияния.
Основными источниками водорода являются влага и органические вещества покрытий (флюсов и газов), загрязнения, ржавчина, окалина на поверхности свариваемых изделий, проволока (при сварке высоко легированных сталей).
В реальных условиях сварки процессы абсорбции и десорбции водорода происходят одновременно. Скорость абсорбции водорода из атмосферы дуги значительно выше, чем скорость десорбции из ванны в более холодных ее частях и увеличивается в повышением силы тока.
Для процессов дуговой сварки характерны значительно большие скорости растворения и более высокие концентрации водорода в закристаллизовавшемся металле в сравнении с процессами большой металлургии. Это объясняется наличием атомарного водорода в атмосфере дуги, большой удельной поверхности металла, находящегося в контакте с газом и высокими скоростями кристаллизации сварочной ванны.
В расплавленном железе и его сплавах водород может существовать в нескольких формах: атомарной, протонной и в составе гидридов (при легировании Ti, Nb). Равновесная концентрация водорода в расплавленном железе, контактирующем с молекулярным водородом, пропорциональна корню квадратному из его парциально давления.
Константа растворимости КН зависит от температуры и состава металла.
Содержание водорода:
1). 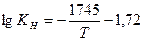 (по М.М. Карнаухову, А.Н. Морозову)
(по М.М. Карнаухову, А.Н. Морозову)
2).  (по по И.Я. Дяконову и А.М. Самарин)
(по по И.Я. Дяконову и А.М. Самарин)
3). 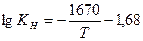 (по Д. Чипмену)
(по Д. Чипмену)
4). 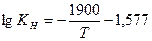 (по Х. Нозаки,)
(по Х. Нозаки,)
Растворимость водорода в Fe рассчитанная по этим уравнениям при 1810 К составляет 23,1; 28,8; 27,7;26,3 см3/100г. В твердом железе при температуре плавлении растворимость водорода составляет 13,5 – 14,5 см3/100г.
максимальная растворимость водорода в железе – 42,5 см3/100г. Наблюдается при 2670 – 2770 К; дальнейшее повышение температуры приводит к интенсивному испарению железа и снижению растворимости водорода в нем вплоть до кипения. Максимальная растворимость Н2 в железе соответствует 2720 … 2770 К и описывается уравнением (В. И. Лакомский).
 ,
,
где SНЖ – растворимость в см3/100г;
Т – температура в К;
Q – теплота испарения железа, кал/моль;
R – газовая постоянная, кал/моль град;
A, B, K – постоянные величины.
Если расплавленное железо контактирует со смесью молекулярного и атомарного водорода, то растворимость описывается формулой
 ,
,
где К – константа;
РН, РН2 – парциальные давления атомарного и молекулярного водорода;
α – степень диссоциации водорода при данной температуре.
На растворимость Н2 в железе значительное влияние оказывают легирующие элементы.
Ti, Nb, Zr, Th, V, редкоземельные элементы повышают растворимость водорода в жидком железе. Эти элементы образуют с водородом гидриды при низкой температуре Ti-H, Nb-N (разного состава).
Mn, Co, Ni, Cr, Mo слабо влияют на растворимость водорода в сплавах с железом.
C, Si, Al, O2 снижают растворимость водорода в расплавленном железе. Предполагается, что они образуют с железом группировки с сильными связями между атомами, снижая тем самым активность атомов железа как абсорбента.
C, Si в концентрациях, встречающихся в сварных швах на низкоуглеродистых низколегированных сталях, незначительно влияет на растворимость водорода. Влияние C, Mn, Si, проявляется лишь в том случае, если содержание этих элементов значительно превышает их содержание в обычных низкоуглеродистых и низколегированных сталях.
Снижает растворимость водорода в жидком железе, низкоуглеродистых и низколегированных сталях кислород (примерно 1,6 раза).
Mn, Si, Al, Ti связывая О2, растворенный в стали, могут косвенно влиять на содержание в ней водорода. Кроме того, при высокой концентрации раскислителей в расплавленной стали замедляется или полностью подавляет реакция взаимодействия углерода с кислородом (кипение ванны), которая в значительной мере может способствовать удалению водорода.
Содержание водорода в металле существенно зависит от кинетики перехода водорода из газообразной фазы в металл и обратно, определяемой в реальных условиях в значительной степени адсорбционными процессами. Переход водорода из шлака в металл сопровождается разрывом связи О−Н. Сохранению электронейтральности границы раздела шлак−металл способствует параллельный переход в металл наиболее сильных ионов Fe2+ и Mn2+. Лучше переходят ионы Fe2+. Присутствие в сплаве поверхностно активных элементов (O, S, C) уменьшает адсорбцию водорода, вакантные участки поверхностного слоя оказываются занятыми атомами O2, S, C. Скорость поглощения и выделения водорода понижается.
Переход Н2 в металл во многих сварочных процессах осуществляется через слой шлака.
В металлургических шлаках растворимы Н2 и пары воды. В шлаках, не содержащих легкоокисляемых окислов (FeO, MnO и др.) растворяются только пары воды. Их фторидных шлаков выделяется водяной пар, а также небольшое количество H2 и HF.
Большинство исследователей полагает, что основная часть водорода находится в шлаке в форме ионов ОН −. В основных и кислых шлаках, содержащих «свободный» кислород, растворение водорода происходит по схеме:
 .
.
Суммарный процесс перехода водородом рассматриваемой границы представляется по схемам
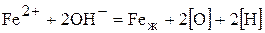
или
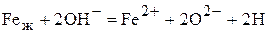
или без участия ионов железа
 .
.
Для кислых шлаков, практически не содержащих свободного кислорода, эта схема имеет следующий вид:
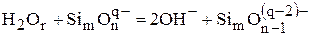 .
.
Количество растворившегося в шлаке водорода
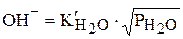 ,
,
где  − константа растворимости.
− константа растворимости.
Если над шлаком находится водород, а не водяной пар, то растворению водорода предшествует процесс окисления, который можно представить уравнением
 .
.
Кислые шлаки растворяют меньше водорода, чем основные, растворимость Н2 в них возрастает с увеличением содержания СаО. Замена СаО на MgO в основных шлаках значительно снижает растворимость водорода.
Водород переходит от поверхности раздела газ−шлак в металл частично путем диффузии (в виде протока) и конвективными потоками.
 см2/с коэффициент диффузии водорода в шлаке. Dнш зависит от вязкости шлака.
см2/с коэффициент диффузии водорода в шлаке. Dнш зависит от вязкости шлака.
Значительное влияние на процесс абсорбции водорода оказывает род тока. При сварке на переменном токе в металле шва значительно больше содержится Н2, чем при сварке постоянным током. Содержание Н2 в металле, наплавленном на прямой полярности выше, чем на обратной.
Концентрация водорода в каплях зависит от их удельной поверхности и времени взаимодействия. При струйном переносе металла наблюдались низкие концентрации водорода в каплях. При струйном переносе металла температура капель приближается к температуре кипения. Парциальное давление паров Fe у реакционной границы газ−металл резко возрастает, а парциальное давление Н2 снижается. Вследствие этого концентрация водорода в каплях уменьшается, несмотря на более высокое содержание водорода газовой смеси.
Пути снижения содержания водорода в металле шва при сварке под флюсом:
− снижение парциального давления водорода в атмосфере дуги путем введения фтористых соединений, карбонатов, окислов марганца;
− уменьшение общего содержания водорода во флюсах путем высокотемпературной термообработки;
− применение постоянного тока обратной полярности;
− использование пемзовидных флюсов, активных добавок и др.
При сварке покрытыми электродами главным источником водорода является покрытие. Значительная часть его содержится во влаге покрытия, в органических материалах, ферросплавах, железном порошке, в виде кристаллизационной влаге в минеральных составляющих покрытия. Даже температура прокалки 670 − 720 К недостаточна для полного удаления влаги из покрытия. Оставшаяся после прокалки влага служит источником водорода в металле шва.
Степень термической диссоциации водяного пара в диапазоне температур, до которых нагреваются капли электродного металла, не превышает 40%. Почти полное разложение водяного пара с образованием свободного водорода или гидроксила происходит при его взаимодействии с железом, ферросплавами и расплавленным шлаком по реакциям:
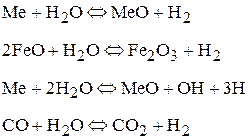
Влияние состава покрытия.
CaF2 значительно снижает концентрацию паров воды в покрытии и шлаке. В общем виде реакция записывается следующим образом:
OH− + F− = HF + O2−.
Существует несколько возможных схем взаимодействия фтористого кальция с парами воды в жидком шлаке:


В покрытиях на основе TiO2−CaF2 водород в атмосфере дуги может соединяться с тетрафторидом титана по реакции

 2017-10-25
2017-10-25 2893
2893
