Активность формально заменяет концентрацию и является расчетной величиной (применяется в аналитической химии). Активность и концентрация связаны между собой соотношением:

Где с – молярная концентрация, а f – коэффициент активности, учитывающий все виды взаимодействия частиц в водном растворе.
F зависит от концентрации и заряда всех присутствующих в растворе ионов.
Значения коэффициента активности для многих ионов определены и приводятся в справочниках.
Из рассмотренных теорий можно сделать вывод – разделение электролитов на сильные и слабые является условным, т.к. результаты более поздних исследований показывают, что в различных условиях вещества могут приобретать свойства как сильных, так и слабых электролитов.
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ м.б. самостоятельно
При растворении твердых тел в воде растворение прекращается, когда наступает равновесие в растворе между растворенным веществом и растворяемым (т.е. получается насыщенный раствор).
Например. В насыщенном растворе сульфата кальция устанавливается равновесие
CаSO4  Cа+2 + SO4–2
Cа+2 + SO4–2
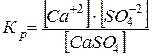
[CаSO4] – концентрация твердой соли, постоянная величина.
Обозначим K×[CаSO4] = K1 следовательно [Cа+2]×[SO4–2] = K1
Т.о. в насыщенном растворе электролита произведение концентрации его ионов величина постоянная, при данной температуре.
 2017-10-25
2017-10-25 609
609








