I. Н2СО3  Н+ + НСО3–
Н+ + НСО3–
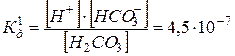
II. НСО3–  Н+ + СО3–2
Н+ + СО3–2

Т.к. 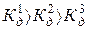 , то диссоциация протекает преимущественно по первой ступени.
, то диссоциация протекает преимущественно по первой ступени.
ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА (самостоятельно)
СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ СЛАБЫХ ЭЛЕКТРОЛИТОВ
НСN  Н+ + СN– процесс обратимый, используя закон действующих масс запишем константу диссоциации
Н+ + СN– процесс обратимый, используя закон действующих масс запишем константу диссоциации
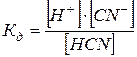
Т.к. циановодород слабый электролит, то не все молекулы распадаются на ионы.
Обозначим исходную концентрацию [HCN] = c.
Тогда концентрация ионов с учетом степени диссоциации [H+] = [CN–] = a×c.
Концентрация нераспавшихся молекул кислоты будет[HCN] = c – a×c.
| НСN | Н+ | СN– | |
| Первоначальная концентрация | c | ||
| Концентрация после диссоциирования | c – a×c | a×c | a×c |
Для установленного после диссоциации равновесия, запишем выражение константы диссоциации и подставим значения всех концентраций.

После преобразования получим:
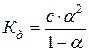
Математическое выражение закона Оствальда.
Т.к. для слабых электролитов степень диссоциации очень мала, то в знаменателе этой величиной можно пренебречь. Тогда
 , отсюда
, отсюда 
Степень диссоциации сильно зависит от константы диссоциации и не может являться критерием для оценки силы электролитов.
СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
Теория Оствальда оказалась несостоятельной для объяснения свойств растворов сильных электролитов.
 2017-10-25
2017-10-25 669
669








