1. Напишите уравнения диссоциации для следующих соединений: серная кислота, гидроксид аммония, хлорид железа (III), сульфат натрия, уксусная кислот, карбонат калия, фосфорная кислота, гидрофосфат калия.
2. Написать в ионно-молекулярной форме уравнения реакций:
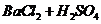 →
→
Na2S + H2SO4 →
3. Написать в ионно-молекулярной форме уравнения реакций между:
а) гидроксидом калия и серной кислотой;
б) хлоридом аммония и гидроксидом натрия;
4. Написать в ионно-молекулярной форме уравнения реакций:
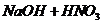 →
→
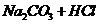 →
→
5. Написать в ионно-молекулярной форме уравнения реакций между:
в) гидроксидом железа (III) и соляной кислотой;
б) йодидом калия и нитратом свинца (II)
6. Какое значение рН имеет раствор, в 500 мл которого растворено 1,825 г соляной кислоты.
7. Написать уравнения реакций в молекулярном виде, полном ионном виде и сокращенном ионном виде:
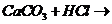
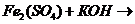
8. По ионной форме уравнения составить уравнение в молекулярном виде:
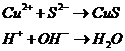
9. Написать в ионно-молекулярной форме уравнения реакций:
К2S + H2SO4 →
FeS + HCl →
10. Написать уравнения гидролиза нитрата меди (II) и сульфита натрия. Определить характер среды.
11. Какие из солей подвергаются гидролизу: сульфат алюминия, сульфид калия, нитрат свинца(II), хлорид калия? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей, определите рН.
12. Определить рН 0,01н. раствора азотистой кислоты, если степень диссоциации азотистой кислоты 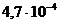 .
.
13. Написать в ионно-молекулярной форме уравнения реакций между:
а) нитратом бария и серной кислотой;
б) хлоридом железа (III) и гидроксидом аммония.
14. Рассчитайте концентрацию ионов H+ (моль/л) в растворе с рН = 2.
15. рН раствора гидроксида натрия равен 12, степень диссоциации 100%. Рассчитайте концентрацию NaOH (моль/л).
 2017-12-14
2017-12-14 597
597








