При уменьшении удельного объема газа υ, т.е. при увеличении р и уменьшении Т свойства реальных газов начинают отличаться от свойств идеального газа. Это связано с уменьшением расстояния между молекулами, из-за чего увеличивается взаимодействие между ними и сказывается объем молекул. Поэтому использование в расчетах модели идеального газа в этом случае приводит к погрешностям.
Для учета свойств реального газа был предложен ряд уравнений реального газа. Одно из первых уравнений предложил Ван-дер-Ваальс в следующем виде  )(
)( - b)= RT,
- b)= RT,
где а и b – постоянные коэффициенты, разные для каждого газа. Поправка  учитывает силы межмолекулярного взаимодействия (внутреннее давление). Как видно, эта поправка возрастает при уменьшении удельного объема
учитывает силы межмолекулярного взаимодействия (внутреннее давление). Как видно, эта поправка возрастает при уменьшении удельного объема 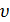 . Поправка b учитывает объем, занимаемый молекулами.
. Поправка b учитывает объем, занимаемый молекулами.
Уравнение Ван-дер-Ваальса качественно хорошо описывает изменение свойств реальных газов при изменении р и Т, но является приближенным.
Для количественных расчетов используют уравнение состояния в виде
 ,
,
где  - коэффициент сжимаемости, зависящий от р и Т и определяемый по опытным данным. Здесь
- коэффициент сжимаемости, зависящий от р и Т и определяемый по опытным данным. Здесь  – приведенное давление,
– приведенное давление,  – приведенная температура, а
– приведенная температура, а  и
и  – критические значения давления и температуры данного вещества (см. ниже).
– критические значения давления и температуры данного вещества (см. ниже).
 2017-10-25
2017-10-25 580
580








