а) для одного кг газа 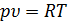 , (1.1)
, (1.1)
где 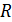 – газовая постоянная, не зависящая от параметров состояния (T, p,
– газовая постоянная, не зависящая от параметров состояния (T, p, 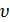 ) и являющаяся индивидуальной для каждого газа. Для воздуха
) и являющаяся индивидуальной для каждого газа. Для воздуха
 .
.
б) для М кг газа 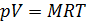 , (1.2)
, (1.2)
где 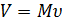 - объем, занимаемый М кг газа.
- объем, занимаемый М кг газа.
в) для одного моля с молекулярной массой М = μ
 , или
, или 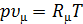 , (1.3)
, (1.3)
где 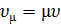 , а
, а 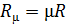 .
.
Моль – этоколичество вещества, которое содержит столько же атомов или молекул, сколько атомов содержится в 12-ти граммах углерода-12 (одного из изотопов углерода).
Это число называется числом Авогадро и приближенно равно 6,022∙1023 частиц на моль.
Атомная единица массы – это 1/12 массы атома углерода-12.
Атомная масса – этовеличина, равная отношению массы данного атома к атомной единице массы.
Атомные массы природных химических элементов указываются в таблице периодической системы элементов Д.И. Менделеева.
Молекулярная масса – это отношение массы молекулы данного вещества также к атомной единице массы.
Молекулярная масса практически равна сумме атомных масс всех атомов, входящих в состав молекулы.
Молярная масса – этомасса одного моля данного вещества независимо от того, состоит оно из одинаковых молекул или включает в себя различные молекулы (как, например, воздух).
Для химически чистых веществ (О2, N2, СО2 и т.д.) молярная масса численно равна их молекулярной массе.
Установлено, что разные газы при одинаковых р и Т имеют равные объемы одного моля  . Например, при р = 101325 Па и Т = 273,15 К
. Например, при р = 101325 Па и Т = 273,15 К
 . Один киломоль (кмоль) равен 1000 молей.
. Один киломоль (кмоль) равен 1000 молей.
Так как  одинаков для всех газов, то из (1.3) следует, что
одинаков для всех газов, то из (1.3) следует, что 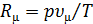 не зависит от рода газа и является одинаковой для всех газов. Она называется универсальной газовой постоянной. Величину
не зависит от рода газа и является одинаковой для всех газов. Она называется универсальной газовой постоянной. Величину 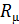 можно определить, если в (1.3) подставить указанные выше значения р, Т и
можно определить, если в (1.3) подставить указанные выше значения р, Т и 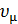 :
:
 .
.
Если известна молекулярная масса какого-либо газа, то его газовая постоянная 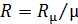 . Так для воздуха
. Так для воздуха 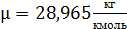 , тогда
, тогда 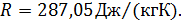
Уравнение состояния идеального газа с достаточной точностью может применяться для определения параметров реальных газов в ГТД, в термодинамических процессах, в задачах аэродинамики и т.д.
 2017-10-25
2017-10-25 537
537








