Любой элементарный процесс с участием электронов, протекающий в плазме, можно охарактеризовать с помощью детальной константы скорости, которая выражается как kdet = s* V [6, 7], тогда полную (кинетическую) константу можно представить в виде:
 . (1.3)
. (1.3)
Ясно, что для вычисления констант скоростей по формуле (1) необходима информация как о сечениях соответствующих элементарных процессов, так и о распределении электронов по скоростям.
К основным элементарным процессам с участием электронов, протекающим в СИНТП, относятся следующие:
1) Упругое рассеяние — при этом процессе происходит обмен импульсами между электроном и тяжелой частицей. Процесс характеризуется дрейфовой скоростью w. Если предположить, что константа скорости данного процесса не зависит от скорости электронов, то для упругого рассеяния получим выражение [6–8]:
 . (1.4)
. (1.4)
2) Неупругое рассеяние — этот процесс характеризуется тем, что происходит перераспределение энергии между партнерами столкновения: кинетическая энергия электронов переходит во внутреннюю энергию тяжелой частицы. При этом может иметь место:
а) электронное возбуждение молекул: М + е → М* + е;
б) колебательно-вращательное возбуждение молекул.
Для «средней» константы возбуждения колебательных уровней молекулы при заданном распределении электронов по энергиям [6, 7, 34]:
 , (1.5)
, (1.5)
где ε кол — средняя колебательная энергия молекулы, w — частота колебаний молекулы, h — постоянная Планка.
3) Ионизация: М + е → М ++ 2 е (как правило одноступенчатая).
Константа скорости ионизации ki определяется кинетическим уравнением:
 , (1.6)
, (1.6)
где п+ — концентрация положительных ионов.
Однако исторически сложилось так, что при изучении процессов ионизации чаще используется таунсендовский коэффициент ионизации a, определяемый как число новых ионов, образованных электроном, прошедшим в газе единичное расстояние в направлении приложенного электрического поля [31]. Первые эксперименты по определению значений коэффициентов aдля различных газов проводились Таунсендом и его учениками [13], а затем целым рядом исследователей. Исчерпывающий обзор полученных результатов и анализ различных эффектов, влияющих на величину a, дан в книге Леба [31–33].
Для аналитического описания зависимости ионизационного коэффициента от напряженности электрического поля Таунсендом [32, 34] была предложена эмпирическая формула:
a/ р = А ехр (– Вр / Е), (1.7)
где р — давление.
Постоянные А и В определяют путем аппроксимации соответствующих экспериментальных кривых. Выражение (1.7) показывает, что a является однозначной функцией отношения Е/р. Необходимо отметить, что в современной научной литературе вместо параметра Е/р используется приведенная напряженность электрического поля E/N. При условии постоянства температуры газа (тяжелых частиц), что, как правило, справедливо для рассматриваемых типов газовых разрядов, указанные выше характеристики электрического поля совпадают с точностью до размерной константы.
Коэффициент ионизации aсвязан с частотой ионизации vi следующим образом: a = vi /w. С другой стороны, в соответствии с результатами [34]:
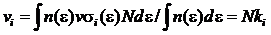 , (1.8)
, (1.8)
где s i — сечение ионизации.
Из приведенных выше соотношений следует уравнение связи между величиной aи константой ki:
a/ N·w = ki (1.9)
Характерной особенностью процессов ионизации является то, что сечения этих процессов имеют пороговый характер (ниже значения потенциала ионизации сечение равно нулю).
4) Прилипание: е + М → М–
Процессы прилипания электронов характеризуются величиной, называемой коэффициентом прилипания η, который является мерой вероятности прилипания электрона на единице длины дрейфового пути [14, 17]. Эта величина аналогична первому ионизационному коэффициенту Таунсенда и определяется теми же формулами, если заменить в них сечение ионизации s i (ε)на сечение прилипания s a (ε):
η = va / w, (1.10)
где va — частота прилипания»
η/ N = f (E / N) (1.11)
Для функции f неизвестны аналитические аппроксимации типа (1.3), тогда для большинства электроотрицательных газов соответствующие зависимости затабулированы.
Связь между величиной ηи константой скорости прилипания электронов задается уравнением:
η/ N*w = k a (1.12)
Прилипание действует как фактор, уменьшающий скорость ионизации. Экспериментально наблюдаемое размножение электронов в лавине определяется разностью коэффициентов ионизации и прилипания
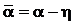
где a — эффективный коэффициент ионизации.
5) Элементарная химическая реакция, например, диссоциация:
е + АВ® A + В + е
это один из наиболее важных процессов для плазмохимического синтеза. Константа скорости этой реакции выражается по приведенной выше формуле (1.3) и зависит от ФРЭС, в частности, от параметра E/N. Сечения процессов диссоциации, также как и ионизации, имеют пороговый xapaктер.
1.3. Механизмы разложения молекул в газовой среде
в условиях высокого напряжения
Специфические особенности электрохимических реакций в газовых разрядах обусловлены тем, что в отличие от традиционных химических процессов они проводятся в системах открытых в термодинамическом смысле: для получения плазмы необходимы внешние источники энергии и часть ее расходуется на осуществление (инициирование) химических процессов [13, 62]. Это же объясняет и существенную неравновесность, наблюдаемую и используемую во многих плазмохимических процессах. Можно выделить три основных этапа в инициировании и проведении электрохимических реакций в условиях плазмы:
- во-первых, энергия от внешнего источника передается в газ через электронную компоненту плазмы;
- во-вторых, электронный газ передает полученную энергию тяжелым частицам в процессах нагрева, возбуждения внутренних степеней свободы атомов и молекул, ионизации и диссоциации. Таким образом, происходит перераспределение энергии внешнего источника между тяжелыми частицами, и создаются химически активные частицы. Обычно, доля, идущая на нагрев газа (особенно в неравновесных условиях) мала и в основном энергия электронов расходуется на возбуждение внутренних степеней свободы атомов и молекул;
- в-третьих, происходят химические превращения в полученной химически активной среде [17, 35].
Таким образом, процессы в электрохимически активной плазме связаны с присутствием трех групп частиц: заряженных, возбужденных и нейтральных невозбужденных (исходные вещества, атомы, радикалы, продукты промежуточных реакций) и роль электронной компоненты плазмы в инициировании реакций является определяющей. Кроме того, плазмохимические системы характеризуются большой плотностью энергии, а присутствие большого числа реакционно-способных частиц ведет к многоканальности плазмохимических процессов. То есть один и тот же суммарный процесс в зависимости от параметров плазмы (давление, степень ионизации, удельный энерговклад и т.д.) может происходить принципиально различными путями [14, 62].
Механизм ионизации в самостоятельных электрических разрядах и, соответственно, напряженность электрического поля в плазме зависят от присутствия газовых добавок и их химической природы. Добавки, оказывающие влияние на механизм ионизации, могут появиться в плазме в результате химических превращений исходных реагентов. В случае прямой ионизации появление легко ионизуемой добавки ведет к уменьшению напряженности электрического поля, тогда как в случае ступенчатой ионизации возможно как увеличение, так и уменьшение напряженности электрического поля. Влияние на напряженность поля может оказать и изменение ионного состава плазмы. Например, введение углеводородов в водородную плазму приводит к замене основного иона с Н3+ на тяжелые углеводородные ионы, что ведет к уменьшению скорости диффузионной гибели заряженных частиц [14, 62–68].
 2017-12-14
2017-12-14 1194
1194
