Метод визначення вмісту Феруму в солях ґрунтується на осадженні розчином амоніаку іонів феруму(III) у вигляді Fe(OH)3, що в разі прожарювання переходить у гравіметричну форму Fe2O3:
Fe3+ + 3NH3∙ H2O → Fe(OH)3↓ + 3NH4+
2Fe(OH)3 → Fe2O3 + 3H2O↑
Якщо в аналізованому матеріалі наявний ферум(II), то його спочатку окиснюють нітратною кислотою
Fe2+ +NO3− + 2H+ → Fe3+ + NO2 + H2O,
а потім осаджують розчином амоніаку.
Якщо ферум(II) не цілком окиснений у ферум(III), то утворюється чорний осад [Fe(OH)2∙ Fe(OH)3] замість червоно-коричневого Fe(OH)3, який слід розчинити в нагрітій розведеній HNO3 та повторити осадження амоніаком.
Осадження Феруму у вигляді гідроксиду здійснюють у процесі нагрівання за наявності електроліту-коагулянта (у протилежному випадку аморфний осад легко може давати колоїдні розчини) із кислого розчину для запобігання гідролізу солей Феруму:
FeCl3 + 2H2O ↔ Fe(OH)2Cl + 2HCl
Fe(OH)2Cl + H2O ↔ Fe(OH)3 + HCl
Реактиви, обладнання: НNO3(ρ= 1,4 г/см3), NH4OHконц., 2%-й розчин NH4NO3, АgNO3 (0,5%), склянки (250–300 см3), лійка, паличка, фільтр беззольний, тигель, муфельна піч, ексикатор, ваги аналітичні АДВ-200.
Хід роботи
Точну наважку аналізованої речовини (близько 0,5 г) розчинимо у 20 см3 дистильованої води в склянці ємністю 250–300 см3, додамо 1–2 см3 HNO3. Розчин нагріємо до кипіння й осадимо концентрованим розчином амоніаку (до слабкого запаху), додамо ще 100–150 см3 гарячої води, доведемо до кипіння, перевіримо повноту осадження (за запахом амоніаку), у разі потреби додамо ще амоніак та відфільтруємо. Спочатку зіллємо через фільтр прозору безбарвну рідину над осадом, осад у склянці кілька разів промиємо, продекантуємо 2%-м розчином NH4NO3, після чого кількісно перенесемо на фільтр. Осад на фільтрі промиємо до негативної реакції на іони Cl– в останній порції фільтрату (проба на іони Cl– із розчином АgNO3). Потім фільтр з осадом помістимо в прожарений до постійної маси тигель, висушимо та озолимо на дуже малому полум'ї пальника. Після повного озолення фільтра тигель з осадом перенесемо в муфельну піч і прожаримо до постійної маси за температури 1000–1100ºС приблизно 40 хв.
Слід мати на увазі, що під час тривалого прожарювання ферум(III) оксид може відновлюватися до ферум(II, III) оксидів:
6Fe2O3 → 4Fe3O4 + O2
Для аналізу повинна бути взята така кількість зразка, щоб маса одержаної гравіметричної форми була 0,05–0,1 г.
Після першого зважування тигля з прожареним осадом знову його прожаримо 15–20 хв і повторно зважимо. Усі результати занесемо у журнал за такою формою:
1. Зважування наважки:
маса човника з наважкою………………
маса порожнього човника…………………....
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
маса наважки……………………………
2. Зважування прожареного осаду:
маса тигля з прожареним осадом
1- ше зважування…………………....
2- ге зважування…………………....
3- тє зважування…………………....
маса порожнього тигля………………………....
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
маса осаду……………………...
Маса осаду вважається постійною, якщо різниця між наступним зважуванням спостерігається лише в четвертому знаку після коми. Обчислення результату аналізу проведемо за формулою
 ,
,
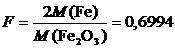 .
.
Лабораторна робота 2
Визначення вмісту Нікелю в розчині
Для осадження Нікелю застосовується органічний реактив диметилгліоксим, запропонований у 1905 р. видатним російським хіміком Л.О. Чугаєвим. Іони нікелю(II) під дією диметилгліоксиму в аміачному середовищі кількісно осаджуються у вигляді кристалічного осаду червоного кольору – комплексної сполуки нікельдиметилгліоксимату

Якщо в розчині наявні йони Феруму (наприклад, у ході визначення Нікелю в сталях), необхідно застосувати комплексоутворювачі, які б утримували Ферум у розчині. До таких належать лимонна та винна кислоти, їх солі та ін.
Одержаний осад нікельдиметилгліоксимату відфільтровують та промивають. Визначення Нікелю можна закінчити двома шляхами:
1) висушуванням осаду до сталої маси за температури 120°С та зважуванням у вигляді нікельдиметилгліоксимату;
2) прожарюванням осаду та зважуванням у вигляді закису нікелю.
Реактиви, обладнання: 1%-й аміачний розчин диметилгліоксиму, HCl (1: 1), 1%-й розчин амоніаку, мірні циліндри (20 см3) склянки (250–300 см3), лійка, скляна паличка, фільтр беззольний “біла стрічка”, тигель, муфельна піч, ексикатор, ваги аналітичні АДВ-200.
Хід роботи
До розчину, який містить нікель(II), додамо 2 см3 HCl (1: 1), розведемо теплою дистильованою водою до 200 см3 та доллємо 20 см3 розчину диметилгліоксиму. Потім додамо амоніак до слабкого запаху після перемішування, обережно нагріємо до температури 70°С та дамо 30 хв відстоятися. Відфільтруємо через беззольний фільтр середньої щільності (“біла стрічка”). Осад продекантуємо 5 разів холодним розбавленим розчином амоніаку (1%-й розчин), перенесемо на фільтр та 5 разів промиємо теплою водою. Зробимо пробу на повноту промивання від хлорид-іонів.
Трохи просушений фільтр помістимо у зважений порцеляновий тигель та прожаримо в муфельній печі за температури 800°С до сталої маси. Перше прожарювання проводять 30 хв, повторне – 15 хв.
Осад NiO зважимо та обчислимо в ньому вміст Нікелю
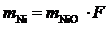 ,
,
 .
.
Лабораторна робота 3
 2017-12-14
2017-12-14 749
749








