Відповідно до рівняння реакції
Н2С2О4 + 2NaOH → Na2С2О4 + 2H2O
f екв. щавлевої кислоти дорівнює 1/2. Тоді молярна маса еквівалента дорівнює 1/2 Н2С2О4·2Н2О. У ході розрахунків слід обов'язково враховувати кристалізаційну воду.
Знайдемо величину наважки щавлевої кислоти (а к). Оскільки число молів еквівалентів (n) щавлевої кислоти, що вступили в реакцію, дорівнює числу молів лугу, витраченого на титрування, тобто
 ,
,
 ,
,
 ,
,
то запишемо
 .
.
Виходячи з того, що С (NaOH) ~ 0,1 моль/л, а V (NaOH) повинен бути в межах 15–20 см3, знайдемо приблизну величину а к .
Реактиви, обладнання: Н2С2О4·2Н2О, х.ч., ~0,1 М розчин NaOH, індикатор фенолфталеїн, бюретка ємністю 25 см3, колби для титрування ємністю 250 см3, ваги аналітичні АДВ-200.
Хід роботи
Розчин лугу із приблизно відомою концентрацією наллємо в бюретку, попередньо промивши її цим же розчином. Для стандартизації розчину лугу три наважки щавлевої кислоти (Н2С2О4·2Н2О), близькі до розрахованої, точно зважимо на аналітичних вагах. Перенесемо їх у три колби для титрування, розчинимо у воді, додамо 2–3 краплі фенолфталеїну та відтитруємо розчином натрію гідроксиду до незникаючого протягом 30–40 с рожевого забарвлення.
За результатами титрування кожної з наважок кислоти розрахуємо C (NaOH), застосовавши формулу
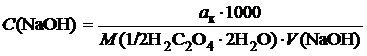 ,
,
і знайдемо середній результат.
Лабораторна робота 12
 2017-12-14
2017-12-14 1100
1100








