1. Потенциальная теория адсорбции Поляни. Десорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и афинность характеристических кривых.
Потенциальная теория Поляни была предложена для термодинамического описания полимолекулярной адсорбции. Она устанавливает связь величины адсорбции с изменением давления пара (газа) и с теплотами адсорбции, исходя из объема адсорбционного пространства. Наиболее удачно теория Поляни предсказывает зависимость величины адсорбции от температуры.
Модель адсорбции в теории Поляни предполагает, что адсорбат ведет себя термодинамически как однокомпонентная система, находящаяся в потенциальном поле поверхностных сил адсорбента, который химически инертен. Теория Поляни принимает, что в адсорбционном пространстве действуют только дисперсионные силы, которые, во-первых, аддитивны, во-вторых, не зависят от температуры.
Введено допущение, что практически все адсорбированное вещество находится на поверхности в жидком состоянии. Это допущение в большой мере соответствует состоянию адсорбата в порах пористых адсорбентов. Именно поэтому подход, используемый в теории Поляни, оказался более пригодным для описания адсорбции на пористых адсорбентах, в порах которых происходит конденсация паров.
За меру интенсивности адсорбционного взаимодействия принят адсорбционный потенциал — работа переноса 1 моль пара, находящегося в равновесии с жидким адсорбатом в отсутствие адсорбента (давление ps) в равновесную с адсорбентом паровую фазу (давление р): 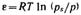 .
.
Этот потенциал характеризует работу против действия адсорбционных сил. Каждой точке изотермы адсорбции соответствуют определенные значения А и p/ps, которые позволяют получить значения V и ε, т. е. найти зависимости адсорбционного потенциала от объема адсорбата на адсорбенте — потенциальную кривую адсорбции.
 Так как дисперсионные силы не зависят от температуры, то от температуры не должна зависеть и форма потенциальной кривой адсорбции, что экспериментально подтверждается во многих случаях. Экспериментальные точки при разных температурах ложатся на одну и ту же кривую ε = f(V), которую поэтому называют характеристической кривой:
Так как дисперсионные силы не зависят от температуры, то от температуры не должна зависеть и форма потенциальной кривой адсорбции, что экспериментально подтверждается во многих случаях. Экспериментальные точки при разных температурах ложатся на одну и ту же кривую ε = f(V), которую поэтому называют характеристической кривой:  , т. е. адсорбционный потенциал при постоянном объеме жидкого адсорбата на адсорбенте (постоянной степени объемного заполнения) не зависит от температуры (температурная инвариантность характеристической кривой).
, т. е. адсорбционный потенциал при постоянном объеме жидкого адсорбата на адсорбенте (постоянной степени объемного заполнения) не зависит от температуры (температурная инвариантность характеристической кривой).
Важная особенность потенциальных кривых адсорбции, заключается в том, что характеристические кривые для одного и того же адсорбента и разных адсорбатов при всех значениях объемов адсорбата в поверхностном слое находятся в постоянном соотношении β: 
Коэффициент β был назван коэффициентом аффинности, Отсюда следует, что, зная характеристическую кривую для одного адсорбата и коэффициент аффинности для другого адсорбата по отношению к первому, можно вычислить изотерму адсорбции второго адсорбата на том же адсорбенте.
2. Природа сил притяжения и отталкивания между частицами в дисперсных системах. Уравнение для энергии притяжения между частицами. Константа Гамакера и ее физческий смысл. Анализ зависимости суммарной энергии взаимодействия частиц от расстояния между ними.
Рассмотрим зависимость от расстояния энергии притяжения частиц — молекулярной составляющей расклинивающего давления. Из сил Ван-дер-Ваальса наиболее универсальны и существенны лондоновские силы дисперсионного взаимодействия.
Энергия электростатического отталкивания пластин равна  .
.
Для вывода уравнения энергии молекулярного притяжении между частицами воспользуемся уравнением энергии притяжения одной молекулы (атома) к поверхности адсорбента (в данном случае частицы): 
Приращение энергии молекулярного притяжения, отнесенное к единице площади, пропорционально приращению числа молекул (атомов) в цилиндре с основанием, равным единице площади, т. е. ndr:

После интегрирования получим:

Величина A12 в уравнении называется константой
Гамакера. Она учитывает природу взаимодействующих тел. Эта константа выражается в единицах энергии и имеет значение порядка 10-19 Дж.
Чем сильнее взаимодействует дисперсная фаза со средой, тем меньше константа Гамакера, это значит, что силы притяжения между частицами уменьшаются.
Для области малых потенциалов суммарная энергия взаимодействия равна


Первичный минимум I отвечает непосредственному слипанию частиц, а вторичный минимум II — их притяжению через прослойку среды. Максимум, соответствующий средним расстояниям, характеризует потенциальный барьер, препятствующий слипанию частиц.
Потенциальный барьер увеличивается с уменьшением константы Гамакера.
3. Рассчитайте межфазное натяжение в системе CaF2-вода, если известно, что растворимость частиц CaF2 диаметром 0,3 мкм превышает нормальную растворимость на 18% при 20ºС. Плотность частиц CaF2 составляет 2500 кг/м3, а молярная масса – 78 г/моль.

 2017-12-16
2017-12-16 993
993








