1. Поверхностно-активные вещества. Влияние строения молекул ПАВ на поверхностную активность (правило Дюкло-Траубе). Вывод уравнения Шишковского. Поверхностное давление. Агрегатное состояние адсорбционных пленок. Весы Ленгмюра.
Поверхностно-активные вещества (ПАВ), молекулы которых имеют дифильное строение и включают большой углеводородный радикал, отличаются высокой поверхностной активностью по отношению к воде, что отражает сильную зависимость поверхностного натяжения водного раствора ПАВ от их концентрации. Большие значения поверхностной активности предполагают пренебрежимо малые концентрации ПАВ в объеме раствора по сравнению с концентрацией их в поверхностном слое, т. е. с величиной их адсорбции на границе раствор — воздух. Подобная зависимость может обнаруживаться и в растворах других веществ на границе с жидкостью или твердым телом, например при специфическом взаимодействии с поверхностью.
Высокая поверхностная активность коллоидных ПАВ зависит, главным образом, от длины углеводородного радикала. Увеличение длины радикала на одну группу CH2 приводит к возрастанию поверхностной активности приблизительно в 3,2 раза (правило Дюклю — Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ.
Для органических сред правило Дюкло — Траубе обращается: поверхностная активность снижается с увеличением длины углеводородного радикала ПАВ.
Вывод уравнения Шишковского: 
После разделения переменных имеем: 
После интегрирования получим уравнение Щищкрвского, характеризующее поверхностное натяжение растворов ПАВ в зависимости от концентрации: 
Подобную зависимость σ от с для ПАВ Б. А. Шишковский получил опытным путем.
При адсорбции или растекании вещества на поверхности образуется поверхностная (адсорбционная) пленка этого вещества. Полученные ранее уравнения изотерм поверхностного натяжения для ПАВ позволяют перейти к уравнениям состояния поверхностных пленок. При очень малых концентрациях ПАВ распределение вещества между раствором и поверхностным слоем описывается законом Генри, а зависимость поверхностного натяжения от концентрации следует указанному выше соотношению. Если в этом соотношении обозначить  и учесть адсорбционное уравнение, то получим:
и учесть адсорбционное уравнение, то получим: 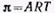
Так как величина А обозначает число молей адсорбированного вещества, приходящееся на единицу поверхности, а обратная ей величина Sм=l/A выражает поверхность, на которой распределен 1 моль адсорбированного вещества, то полученному соотношению можно придать вид: 
Это уравнение аналогично, уравнению состояния идеального газа. Различие состоит в том, что вместо объема 1 моль газа здесь выступает поверхность, занимаемая 1 моль ПАВ, а вместо давления газа — разность поверхностных натяжений, которая получила название давления двухмерного газа, или двухмерного давления. В соответствии с этим полученное соотношение называют уравнением состояния идеального двухмерного газа.
В зависимости от условий, природы ПАВ и подложки образуются поверхностные пленки, которые по свойствам подобны веществам в трех агрегатных состояниях — газообразном, жидком и твердом. Состояние пленки зависит также и от концентрации растекающегося (адсорбирующегося) вещества на поверхности. Если концентрация мала и взаимодействие молекул в поверхностном слое слабое (большой коэффициент растекания), то молекулы ПАВ движутся по поверхности независимо друг от друга. Такое состояние напоминает поведение газа, поэтому пленку называют газообразной.
Пленки, образованные при сплошном заполнении поверхностного слоя, 'называют конденсированными. Они могут быть жидкими и твердыми. Твердые пленки обладают структурой, подобной структуре твердого тела. Такая пленка если и течет, то очень медленно.
 Возможность существования поверхностных пленок в различных агрегатных состояниях впервые было наглядно показано Ленгмюром. Он специально сконструировал весы для измерения поверхностного (двухмерного) давления. Принцип метода измерения состоит в следующем. В кювету 1 наливают до краев подлежащую жидкость и на ее поверхность между неподвижной 2 и подвижной 3 планками наносят вещество, образующее мономолекулярную пленку. В процессе теплового движения молекулы вещества ударяются о планку и создают давление, которое можно уравновесить и измерить с помощью разновесов в чашечке 4. Передвигая планку 3, можно изменять площадь, занимаемую молекулами пленки, и тем самым изменять ее двухмерное давление.
Возможность существования поверхностных пленок в различных агрегатных состояниях впервые было наглядно показано Ленгмюром. Он специально сконструировал весы для измерения поверхностного (двухмерного) давления. Принцип метода измерения состоит в следующем. В кювету 1 наливают до краев подлежащую жидкость и на ее поверхность между неподвижной 2 и подвижной 3 планками наносят вещество, образующее мономолекулярную пленку. В процессе теплового движения молекулы вещества ударяются о планку и создают давление, которое можно уравновесить и измерить с помощью разновесов в чашечке 4. Передвигая планку 3, можно изменять площадь, занимаемую молекулами пленки, и тем самым изменять ее двухмерное давление.
По зависимости поверхностного давления пленки от площади поверхности, приходящейся на 1 молекулу (1 моль) вещества пленки, можно судить о состоянии пленки.
Резкое увеличение поверхностного давления при сжатии пленки отвечает образованию сплошного мономолекул яркого слоя, в котором молекулы плотно прижаты друг к другу. Если площадь sм0, на которой размещен таким образом 1 моль вещества, разделить на число Авогадро, то получим площадь, непосредственно занимаемую одной молекулой:

2. Факторы агрегативной устойчивости лиофобных дисперсных систем. Электролитная коагуляция (концентрационная и нейтрализационная коагуляция). Правило Шульце-Гарди и закон Дерягина. Способы стабилизации лиофобных дисперсных систем.
Различают следующие термодинамические и кинетические факторы агрегативной устойчивости дисперсных систем:
1. Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана.
2. Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации)
3. Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении.
4. Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5. Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6. Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах, и об агрегативной устойчивости таких систем судят по скорости коагуляции.
Коагуляция может происходить как без внешнего воздействия на систему, так и при повышении температуры, межаническом, электрическом или другом воздействии, а в случае золей – при ведении коагулянтов, например электролитов.
Принято считать, что типичные лиофобные системы агрегатнвно устойчивы благодаря проявлению электростатического фактора стабилизации и коагулируют при введении в систему сравнительно небольших количеств любых электролитов. Наименьшая концентрация электролита см, при которой начинается коагуляция (медленная), называется порогом коагуляции. Для осуществления быстрой коагуляции требуется такая концентрация электролита сб, после увеличения которой скорость коагуляции остается постоянной (когда фактор устойчивости W=1, или потенциальный барьер ΔE = 0).
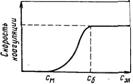 Зависимость скорости коагуляции от концентрации электролита показана на рисунке. Из этого рисунка следует, что введение электролита в дисперсную систему снижает потенциальный барьер, который при быстрой коагуляции (максимальной скорости) становится равным нулю. Порог коагуляции существенно зависит от момента его фиксирования, от метода наблюдения за коагуляцией (изменение интенсивности рассеяния света, реологических свойств и др.) и от концентрации золя, поэтому необходимо всегда подробно указывать условия определения этой величины.
Зависимость скорости коагуляции от концентрации электролита показана на рисунке. Из этого рисунка следует, что введение электролита в дисперсную систему снижает потенциальный барьер, который при быстрой коагуляции (максимальной скорости) становится равным нулю. Порог коагуляции существенно зависит от момента его фиксирования, от метода наблюдения за коагуляцией (изменение интенсивности рассеяния света, реологических свойств и др.) и от концентрации золя, поэтому необходимо всегда подробно указывать условия определения этой величины.
В соответствии с теорией ДЛФО введение электролита в дисперсную систему вызывает сжатие двойного электрического слоя на поверхности частиц, вследствие чего они могут подойти друг к другу на расстояния, на которых преобладают силы притяжения. Уменьшение толщины двойного слоя сопровождается обменом противоионов этого слоя на вызывающие коагуляцию ионы электролита.
Закон Дерягина: 
При высоких потенциалах порог быстрой коагуляции по теории ДЛФО не зависит от потенциала и обратно пропорционален заряду противоиона в шестой степени, что хорошо обосновывает известное эмпирическое правило Шульце — Гарди. По правилу Шульце — Гарди значения порогов коагуляции для электролитов с зарядами противоионов 1, 2, 3 находятся в соотношении 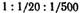 .
.
Чтобы обеспечить агрегативную устойчивость дисперсных систем, частицы которых имеют лиофобную поверхность, применяют стабилизаторы, способствующие увеличению межфазного взаимодействия. В качестве таких стабилизаторов широко применяют ПАВ и ВМС (имеющие неполярные и полярные части молекул), лиофилизируюшие поверхность частиц дисперсной фазы.
Стабилизацию лиофобных дисперсных систем с помощью лнофильных коллоидов (в первую очередь, ВМС) называют защитным действием стабилизаторов — коллоидной защитой.
3. Используя уравнение Дубинина-Радушкевича, рассчитайте объем микропор сажи на основе данных об адсорбции паров бензола (мольный объем бензола 88,8 см3/моль):
| P/Ps | А, моль/кг |
| 0,3 | 1,10 |
| 0,4 | 1,38 |
| 0,5 | 1,60 |

 2017-12-16
2017-12-16 1760
1760







